Johnson & Johnson hat bei der Europäischen Arzneimittelagentur (EMA) die Zulassung für sein Psoriasis-Medikament mit dem Wirkstoff Icotrokinra beantragt. Damit steht zum ersten Mal ein Medikament vor der Zulassung, das als Tablette eingenommen wird und gezielt den IL-23-Rezeptor blockiert.
Icotrokinra wurde speziell dafür entwickelt, den Interleukin-23-Rezeptor zu blockieren. Interleukin-23 ist ein Botenstoff im Körper. Er feuert die Entzündung bei der Schuppenflechte stark an. Icotrokinra fängt diesen Botenstoff quasi ab. Dadurch kann die Entzündung in der Haut abklingen.
Die Psoriasis-Medikamente Ilumetri, Skyrizi und Tremfya setzen auch am IL-23 an, doch anders als sie muss Icotrokinra nicht gespritzt werden. Vielmehr wird es einmal täglich eingenommen. Das macht die Behandlung für viele Betroffene deutlich einfacher und angenehmer.
Der Zulassungsantrag basiert auf den Ergebnissen von vier großen Phase-3-Studien. Diese Studien haben alle ihre Hauptziele erreicht. In den Untersuchungen nahmen insgesamt mehr als 1000 Erwachsene und Jugendliche teil.
In der wichtigsten Studie ICONIC-LEAD erreichten 65 Prozent der Patienten eine erscheinungsfreie oder fast erscheinungsfreie Haut. Bei der Placebo-Gruppe waren es nur acht Prozent. Außerdem erreichten 50 Prozent der mit Icotrokinra behandelten Patienten eine 90-prozentige Verbesserung ihrer Hauterscheinungen. Bei Placebo lag dieser Wert nur bei 4 Prozent.
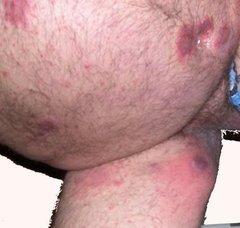
Die Studie ICONIC-TOTAL zeigte, dass Icotrokinra auch bei Psoriasis an Kopfhaut, Genitalbereich sowie an Händen und Füßen gut wirkt. Diese Körperstellen sind für Patienten besonders belastend, da sie oft sichtbar sind oder das tägliche Leben stark beeinträchtigen.
Hersteller Johnson & Johnson hat mit Icotrokinra viel vor: "Das Medikament könnte als systemische Erstlinientherapie zum Einsatz kommen", wurde eine Vertreterin der Firma in einer Pressemitteilung im März 2025 zitiert.
In direkten Vergleichsstudien schnitt Icotrokinra besser ab als Deucravacitinib (Medikamentenname: Sotyktu). Das wird ebenfalls als Tablette eingenommen. Die Studien ICONIC-ADVANCE 1 und ICONIC-ADVANCE 2 zeigten, dass Icotrokinra bei allen wichtigen Messgrößen bessere Ergebnisse erzielte.
Icotrokinra wurde auch bei Jugendlichen ab 12 Jahren untersucht. Die Studien zeigten, dass das Medikament auch in dieser Altersgruppe gut wirkt und sicher ist. Das ist wichtig, da Psoriasis oft schon im Jugendalter beginnt und die Lebensqualität stark beeinträchtigen kann.
Nebenwirkungen von Icotrokinra
In gepoolten Sicherheitsanalysen traten bei 49,1 Prozent der Icotrokinra-Patienten Nebenwirkungen auf. Bei der Placebo-Gruppe waren es 51,9 Prozent. Die Nebenwirkungsrate war also sogar etwas niedriger als bei Placebo. Neue oder unerwartete Sicherheitssignale wurden nicht beobachtet. Eine gepoolte Sicherheitsanalyse fasst die Sicherheitsdaten aus mehreren klinischen Studien zusammen, um bei einer größeren Patientenzahl eine zuverlässigere Bewertung der Nebenwirkungen und Risiken eines Medikaments zu ermöglichen.
Die wichtigsten Nebenwirkungen waren
- COVID-19 (die Studien dürften in die Corona-Zeit gefallen sein; 11 Prozent in der Icotrokinra-Gruppe meldeten Symptome gegenüber 12 Prozent in der Placebo-Gruppe in der Studie FRONTIER 1)
- Nasopharyngitis (Erkältung; 7 Prozent in der Icotrokinra-Gruppe gegenüber 5 Prozent in der Placebo-Gruppe in der Studie FRONTIER 1).
- Infektionen der oberen Atemwege
- Durchfall (5 Prozent in allen Dosierungsgruppen zusammen in der Studie FRONTIER 1)
Weitere Studien laufen
Aktuell läuft die Studie ICONIC-ASCEND, in der Icotrokinra direkt mit dem Biologikum Ustekinumab verglichen wird. Außerdem werden zwei Studien bei Psoriasis arthritis durchgeführt. Diese Studien sollen zeigen, ob Icotrokinra auch bei anderen IL-23-vermittelten Erkrankungen hilft.
Wie geht es nach dem Antrag weiter?
Johnson & Johnson hat bereits im Juli 2025 auch bei der amerikanischen Behörde FDA eine Zulassung beantragt. Der Antrag in Europa folgte im September 2025.
Nach dem Antrag prüft die Europäische Arzneimittelagentur (EMA) zunächst die vollständigen Unterlagen zum Medikament. Die Bewertung übernimmt dabei ein Expertengremium, das sogenannte CHMP (Committee for Medicinal Products for Human Use), dem Wissenschaftler aus allen EU-Staaten angehören.
Zwei Länder – der "Rapporteur" und der "Co-Rapporteur" – sind dabei federführend und erstellen einen ersten Bewertungsbericht. Alle beteiligten Länder können diesen Bericht kommentieren, bevor im gesamten Ausschuss über das Medikament beraten wird. Nach Abschluss der wissenschaftlichen Prüfung gibt das Gremium eine Empfehlung ab: entweder für oder gegen die Zulassung. Diese Empfehlung geht an die Europäische Kommission, die die eigentliche Zulassung erteilt. Mit dieser zentralen Zulassung ist das Medikament in allen EU-Staaten inklusive Island und Norwegen zugelassen.
Bei innovativen oder dringend benötigten Arzneimitteln kann eine "beschleunigte Bewertung" erfolgen, die das Verfahren auf 150 Tage verkürzt. Allerdings zielt der Antrag für Icotrokinra offensichtlich nicht auf eine beschleunigte Zulassung als innovatives oder dringend benötigtes Arzneimittel ab. Weder in den Pressemitteilungen von Johnson & Johnson noch in den Berichten über die EMA-Einreichung wird eine beschleunigte Bewertung oder ein Sonderstatus erwähnt.
Dies bedeutet, dass Icotrokinra das reguläre EMA-Zulassungsverfahren durchlaufen wird, das normalerweise 12 bis 18 Monate dauert. Ohne beschleunigte Bewertung können Patienten in Europa also frühestens Ende 2026 oder Anfang 2027 mit einer möglichen Markteinführung voni Icotrokinra rechnen.


 Claudia Liebram ist Journalistin in Berlin. Ihre Psoriasis begann, als sie drei Jahre alt war. Sie absolvierte den Masterstudiengang "Consumer Health Care" an der Berliner Charité.
Claudia Liebram ist Journalistin in Berlin. Ihre Psoriasis begann, als sie drei Jahre alt war. Sie absolvierte den Masterstudiengang "Consumer Health Care" an der Berliner Charité.

Empfohlene Kommentare
Erstelle ein Benutzerkonto oder melde dich an, um zu kommentieren
Du musst ein Benutzerkonto haben, um einen Kommentar verfassen zu können
Benutzerkonto erstellen
Neues Benutzerkonto für unsere Community erstellen. Es ist einfach!
Neues Benutzerkonto erstellenAnmelden
Du hast bereits ein Benutzerkonto? Melde dich hier an.
Jetzt anmelden