Suchen und finden
Beiträge zum Thema 'Nebenwirkungen'.
-
Was denken Patienten mit entzündlichen Gelenkerkrankungen über ihre Medikamente? Rheumatologen aus Portugal haben sich das einmal genauer angeschaut. Ärzte in einem Krankenhaus in Portugal haben 58 Rheuma-Patienten gefragt, wie skeptisch sie ihren Medikamenten gegenüberstehen. 25 Patienten davon hatten Psoriasis arthritis. Die Ergebnisse, kurz gefasst: Die Patienten mit PsA und die, die jünger waren, hatten deutlich mehr Bedenken wegen Nebenwirkungen – im Vergleich zu denen mit Rheumatoider Arthritis und den Älteren. Die Patienten mit Rheumatoide Arthritis machten sich bei Medikamenten zum Spritzen mehr Sorgen wegen einer Langzeit-"Giftigkeit" als die mit Tabletten. Patienten mit nicht so schlimmer Rheumatoider Arthritis waren stärker davon überzeugt, dass sie Medikamente einnehmen sollten, als die mit einer stärkeren Erkrankung. Quelle: Ärzte Zeitung, 06.06.2022
-

Tofacitinib (Xeljanz) – nicht mehr für alle Betroffenen
Rolf Blaga erstellte ein Artikel in Tofacitinib
Mit dem Wirkstoff Tofacitnib (Xeljanz) sollen folgende Patientengruppen möglichst nicht mehr behandelt werden: - wer über 65 Jahre alt ist, - wer raucht oder früher geraucht hat. - wer gefährdet ist, an Herz-/Kreislaufproblemen oder bösartigem Krebs zu erkranken. Für diese Personengruppen erhöht Tofacitinib das Risiko eines schweren Herz-Kreislauf-Ereignisses und von Krebserkrankungen (außer weißen Hautkrebs). Das ist unabhängig davon, - wegen welcher Erkrankung man mit Tofacitib behandelt wird und - wie viel man davon täglich einnimmt (Dosis). Betroffene Patienten sollten mit ihrem Arzt besprechen, ob es alternative Behandlungsmöglichkeiten gibt. Wenn trotzdem mit Tofacitinib weiterbehandelt werden muss, sind regelmäßige Kontrolluntersuchungen durchzuführen. Diese Beschränkungen sind das Ergebnis einer erneuten Risikoüberprüfung durch die Europäischen Arzneimittel Behörde (EMA). Das gab die die Herstellerfirma Pfizer im Juni 2021 bekannt. Das Risiko von schweren Arzneimittelwirkungen musste noch einmal neu bewertet werden. Denn im Februar 2021 informierten die US-amerikanische Zulassungsbehörde FDA und der Pharmakonzern Pfizer über bis dahin nicht bekannte, gefährliche bis hin zu tödlichen Folgen. Das hatte eine Langzeit-Sicherheitsstudie ergeben. An der hatten mehr als 4.000 Patienten teilgenommen. Die waren älter als 50 Jahre und hatten mindestens einen Risikofaktor für Herz-Kreislauf-Probleme. Genau das ist überwiegend der typische Tofacitinib-Patient. Verglichen wurden sie mit Gleichbetroffenen, die mit TNF-Alpha-Blockern (Adalimumab oder Etanercept) behandelt wurden. Die Tofacitinib-Patienten erkrankten häufiger an (Lungen-) Krebs als Betroffene in der Vergleichsgruppe. Außerdem traten bei ihnen öfters schwere "herzbezogene" Ereignisse auf – vor allem Herzinfarkte. Das war unabhängig davon, welche Dosierung sie eingenommen hatten. Es betraf also alle Tofacitinib-Patienten. Xeljanz wird bei Psoriasis arthritis und Rheumatoider Arthritis in einer Dosis von 5 mg zweimal täglich eingenommen. In dieser Gruppe erkrankten 4,2 Prozent der Teilnehmer an Krebs, in der Biologika-Gruppe dagegen 2,9 Prozent. Schwere Herz-Kreislauf-Ereignisse gab es bei 3,2 Prozent der Tofacitinib-Patienten gegenüber 2,6 Prozent bei den Biologika- Behandelten. Mit einem erneuten „Rote-Hand-Brief“ warnte die Herstellerfirma Pfizer deshalb die Öffentlichkeit im März 2021. Mehrere Warnungen gingen voraus Im März 2019 gab es eine erste Warnung. Die bezog sich in der EU nicht auf Psoriasis arthritis- oder Rheumatoide-Arthritis-Patienten, denn für die ist nur die geringe Dosis zugelassen. In der EU darf die erhöhte Dosierung (2-mal je 10 mg pro Tag) nur bei Colitis ulcerosa angewendet werden. Bei dieser Dosis kam eine Lungenembolie 5-mal häufiger vor und es starben mehr Studienteilnehmer daran als in der Vergleichsgruppe. Das Fazit schon "damals": Patienten und Ärzte sollten vorsichtshalber bei allen mit Tofacitinib Behandelten auf Zeichen und Symptome von Lungenembolie achten. Im Mai 2019 wurde genau aufgeführt, welche Patienten nicht mit der höheren Dosis behandelt werden dürfen – nämlich alle Patienten mit Herzschwäche Blutgerinnungsstörungen früheren Thrombose-Ereignissen (einschließlich Lungenembolie) Krebs sowie Risikogruppen (Raucher, Übergewichtige, Senioren und Bewegungsarme). Außerdem gehören Frauen dazu, die „die Pille“ einnehmen. Im Oktober 2019 riet der Sicherheitsausschuss (PRAC) der europäischen Zulassungsbehörde (EMA), das Präparat deshalb mit Vorsicht anzuwenden. Im März 2020 wurden die Warnungen erneut präzisiert: Wiederum ging es um Rheuma-Patienten, die die in der EU nicht erlaubte höhere Dosis bekommen. Bei denen wurden nicht nur vermehrt Blutgerinnsel in der Lunge festgestellt, sondern es starben auch mehr dieser Patienten daran. Außerdem seien verstärkt tiefe Venenthrombosen aufgetreten. Das „ist nach dem Herzinfarkt und Schlaganfall die dritthäufigste akut auftretende kardiovaskuläre Erkrankung“. Erstmals wurde empfohlen, alle Tofacitinib-Patienten über 65 Jahre möglichst auf ein anderes Mittel umzustellen, denn sie seien zusätzlich infektionsanfälliger und hätten deshalb ein höheres Risiko daran zu sterben. Bisher kein erhöhtes Krebsrisiko beobachtet Professor Burmeister ist ein international anerkannter Rheumatologe von der Berliner Charité. Er weist auf unsere Nachfrage auf die in der Praxis erhobenen Daten hin. Die hätten kein erhöhtes Krebsrisiko von Tofacitinib gegenüber anderen Medikamenten festgestellt. Das bestätigen z.B. 13 Beobachtungsstudien von 2012 - 2018 In den USA gibt es ein Rheuma-Register, das die Daten von über 50.000 Patienten speichert. Die Auswertung von 2012 bis 2019 ergab, dass Tofacitinib-Patienten nicht häufiger an Krebs erkranken würden, als diejenigen, die mit Biologika behandelt wurden. Es fällt schwer zu entscheiden, wie groß das Risiko tatsächlich ist. Beobachtungen und Meldungen an ein Register sammeln die Fallzahlen schwerwiegender Arzneimittelwirkungen von möglichst vielen Patienten in der Praxis. Im stressigen Praxisalltag aber unterlaufen eher Fehler und Schludrigkeiten. Eine wissenschaftliche Studie, die ausdrücklich zur Nachbeobachtung gedacht war, kann dagegen tatsächliche Zusammenhängen exakter erfassen. Siehe auch: „Psoriasis-Register – Sicherheit im Blick“. Aber sie bezieht sich auf deutlich weniger Patienten, als alle bekannten "Real-Word-Studies". Xeljanz-Anwender sollten das Risiko kennen Über das Endergebnis im Februar 2021 hat als erstes das arznei-telegramm berichtet. Schon vor der Zulassung sei aufgefallen, dass es mehr Fälle von Lungenkrebs gegeben habe als bei vergleichbaren Medikamenten. Die EMA hätte das Präparat aus diesem Grund zunächst nicht zugelassen. Der Hersteller Pfizer wurde deshalb von der FDA verpflichtet, eine so genannte „ORAL-Surveillance-Studie“ über fünf Jahre durchzuführen. Die Redaktion des arznei-telegramms hielt die vorliegenden Daten für „bedenklich“. Sie bewertete die Nutzen-Schaden-Bilanz bei allen Erkrankungen, für die der Wirkstoff zugelassen ist, als „negativ.“ Ihr Fazit: JAK-Hemmer sollten nicht mehr neu verschrieben werden. Wer bisher damit behandelt wurde, sollte über die Risiken aufgeklärt und möglichst auf einen anderen Wirkstoff umgestellt werden. Wenn es sich bestätige, dass auch unter der niedrigen Dosierung häufiger Patienten sterben, müsse der Wirkstoff Tofacitinib vom Markt genommen werden. Im Gegensatz zur ersten Reaktion des arznei-telegramms hat der EMA-Sicherheitsausschuss (PRAC) dann im Juni 2021 nur für die oben genannten Personengruppen vor Tofacitinib gewarnt. Alle anderen würden keine höheren Risiken eingehen. Was tun als Patient? Diejenigen, die weiterhin mit diesem Wirkstoff behandelt werden, sollten gemeinsam mit dem Arzt besprechen, was regelmäßig zu kontrollieren ist. Es kommt darauf an, erste Anzeichen von Lungenkrebs, Lungenembolie, Venenthrombose oder Herzinfarkte zu erkennen. Auch sollte regelmäßig eine Krebsvorsorge durchgeführt werden. Alles, was bisher bekannt geworden ist, verunsichert vermutlich nicht nur Patienten. Mögliche schwerwiegende bis tödliche Folgen gehen über das hinaus, was von anderen Präparaten gegen chronisch-entzündliche Gelenkerkrankungen bekannt ist. Es ist vermutlich überwiegend die typische Zielgruppe des Wirkstoffs, die jetzt darauf verzichten soll. Es ist eher unwahrscheinlich, aber nicht völlig ausgeschlossen, dass in Zukunft weitere Risikogruppen bekannt werden. Unwahrscheinlich, weil das Präparat Xeljanz in den USA seit 2012, in der Schweiz seit 2013 und in der EU seit 2017 zugelassen ist. Möglich, weil es bei jedem Medikament Langzeitwirkungen geben kann, die sich erst nach sehr langer Zeit zeigen. Tipps zum Weiterlesen EMA startet Sicherheits-Review zu Januskinase-Hemmern (Pharmazeutische Zeitung, Februar 2022) FDA: Xeljanz (Tofacitinib): Erhöhtes Risiko für schwerwiegende kardiale Ereignisse sowie Tumore (Arzneimittelkommission der Deutschen Apotheken (AMK) Tofacitinib: Nutzen-Schaden-Verhältnis sorgsam abwägen! Deutsche Apotheker Zeitung (DAZ) Bei Xeljanz auf die Lunge achten Xeljanz – was ist das und wie wird es angewendet-
- arznei-telegramm
- Herz-Kreislauf-Erkrankungen
-
(und 2 mehr)
Markiert mit:
-
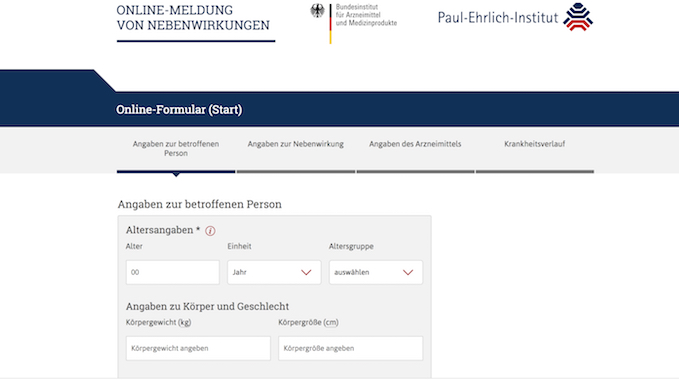
Wer nach dem Eincremen oder Einnehmen eines Medikamentes eine Nebenwirkung verspürt, kann jetzt seine Beschwerden bei den Behörden loswerden: Die haben ein Meldeportal für Verdachtsfälle von Nebenwirkungen in Netz gestellt. Den Arztbesuch sollte das aber nicht ersetzen. Im Prinzip klingt es logisch: Je mehr und besser der Verdacht einer Nebenwirkung an Behörden gemeldet wird, desto schneller können die auf häufige Beschwerden aufmerksam werden. So könnten Nebenwirkungen gefunden werden, die vielleicht während einer Studie nicht so oft aufgetreten sind oder die erst bei längerem Gebrauch eines Arzneimittels auftreten. Wenn Patienten ihren Ärzten von Nebenwirkungen berichten, sollten die sie je nach Schwere weitergeben. Seit einigen Jahren können Patienten das aber auch selbst tun. Doch das Formular dafür auf der Internetseite war bislang ziemlich krude und nicht leicht zu bedienen. Seit Ende September 2018 ist eine modernisierte Version der Internetseite für die Meldung online. Unter nebenwirkungen.pei.de kann jeder den zuständigen Arzneimittelbehörden noch einfacher Nebenwirkungen melden. Neu ist das klar strukturierte, barrierefreie Formular, das allgemeinverständlich durch den Vorgang leitet. Wer etwas meldet, muss nicht wissen, welche Behörde für das betreffende Arzneimittel zuständig ist. Und: Jeder kann anonym bleiben. Am Ende der Prozedur gibt es lediglich eine Bearbeitungsnummer. Die Meldungen werden an die "Europäische Datenbank gemeldeter Verdachtsfälle von Arzneimittelnebenwirkungen" weitergeleitet. Wer eine andere Sprache der EU besser beherrscht als Deutsch, kann diese EU-Datenbank nutzen, um seine Erfahrung mit einem Medikament mitzuteilen. Sie zeigt auch die europaweit gemeldeten Verdachtsfälle von Arzneimittelnebenwirkungen an. Hinter der Internetseite stehen das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) und das Paul-Ehrlich-Institut. Die dortigen Wissenschaftler werten aus, was die Betroffenen eintragen. Bislang nicht oder wenig bekannte Nebenwirkungen sollen so schneller aufgespürt werden – auch, damit bei Bedarf schneller reagiert werden kann, wenn sich bei einem Medikament gehäuft Nebenwirkungen zeigen.
-
Wer mit dem Wirkstoff Secukinumab (Cosentyx) behandelt wird, sollte bei Problemen mit den Ohren nicht nur zum Hals- / Nasen- / Ohrenarzt gehen, sondern auch mit dem Hautarzt darüber sprechen. Ohreninfekte gehören zu den gelegentlich vorkommenden Nebenwirkungen dieses Biologikums. Das betrifft zwar sehr wenige Secukinumab-Patienten. Aber nicht jeder führt Ohrenbeschwerden direkt auf das Psoriasis-Medikament zurück. Das kritische arznei-telegramm (a-t) weist in der Ausgabe 6 / 2018 auf diesen Zusammenhang hin. Die Welt-Gesundheits-Organisation (WHO) habe 24.729 Verdachtsberichte über Nebenwirkungen bei Secukinumab bekommen. Davon seien 101 Ohr-Infektionen gewesen (0,4 Prozent), 11 Mittelohrentzündungen, 9 Gehörgangsentzündungen und 5 Trommelfell-Perforationen. In klinischen Studien wären Ohren-Infektionen bei 300 mg-Dosierungen häufiger vorgekommen, als bei 150 mg. Mit der höheren Dosis werden Patienten mit Plaque Psoriasis behandelt. Die niedrigere Dosis erhält man bei Psoriasis arthritis (PsA). Das a-t berichtet von einem (!) besonders krassen Fall: Die PsA-Patienten erlitt durch Secukinumab letztendlich einen Innenohrschaden mit einseitiger Schwerhörigkeit und Gleichgewichtsstörungen. Auch wenn es extrem selten vorkommt: Wer während der Behandlung mit Secukinumab (Cosentyx®) Probleme mit den Ohren hat, sollte bei den ersten Anzeichen mit dem Dermatologen darüber reden. In Zusammenarbeit mit dem HNO-Arzt kann dann entschieden werden, ob das Medikament weiter genommen werden sollte.
-
- Cosentyx Erfahrungen
- Medikamente
-
(und 2 mehr)
Markiert mit:
-

Biologika können Darmerkrankungen aus der Reserve locken
Rolf Blaga erstellte ein Artikel in Medikamente
Wer mit Biologika wie Cosentyx, Taltz oder Kyntheum behandelt wird, sollte abklären, ob er eine chronisch entzündliche Darm-Erkrankung (CED) haben könnte. Die Arzneimittelkommission der deutschen Ärzteschaft warnt: Es bestehe der Verdacht, dass diese Biologika für schwere Darmentzündungen verantwortlich sind oder bisher unentdeckte Darmentzündungen verschlimmern. Typische Symptome sind ständig wiederkehrende Bauchschmerzen oder Durchfälle. Wichtig: Wer mit einem der Medikamente behandelt wird, muss nicht panisch werden. Nur sehr wenige sind betroffen – nach Angaben der AKdÄ weniger als 1 Prozent. Darmprobleme abchecken Die Arzneimittelkommission (AKdÄ) führt seit längerem eine Datenbank, in die Patienten und Ärzte alle beobachteten Nebenwirkungen eintragen können. Dort seien Fälle gemeldet worden, bei denen sich unter Cosentyx (Secukinumab) eine bisher unauffällige verlaufende CED akut verschlechtert hat, schreibt die AkdÄ. Andere Meldungen würden vermuten lassen, dass durch den Wirkstoff bei vorher gesunden Patienten eine CED ausgelöst wurde. Da die Biologika Taltz (Ixekizumab) und Kyntheum (Brodalumab) ebenfalls am IL-17 ansetzen, seien ähnliche Folgen zu erwarten. Deshalb sollten diese Patienten nach einer CED-Vorerkrankung gefragt werden. Nur bei Kyntheum wird schon jetzt ein „aktiver“ Morbus Crohn abgeklärt. Das Medikament darf dann nicht gegeben werden. Die AKdÄ empfiehlt außerdem, diese Patienten regelmäßig danach zu fragen, ob verdächtige, länger anhaltende Darmprobleme aufgetreten sind. IL-17-Blockade fördert Darmentzündungen Die genannten Biologika sind Antikörper, die auf die Zytokinfamilie Interleukin-17 [1] zielen. Sie verhindern, dass deren entzündungsfördernde Signale an das Immunsystem weitergeleitet werden. Aber ein Botenstoff kann mehrere Funktionen haben. So wird beim Fehlen des IL-17 gleichzeitig die Barrierefunktion der Darm-Schleimhaut geschwächt. Das aber könne dort zu verstärkten Entzündungsreaktionen führen, schreibt die AKdÄ. Langfristig könne sich dadurch eine CED entwickeln. Die Kommission weist aber darauf hin, dass diese Zusammenhänge nicht endgültig bewiesen seien. Dazu würden bisher zu wenig Daten vorliegen. Sie seien aber „biologisch plausibel“, wären schon bei Mäusen nachgewiesen und würden durch Fallberichte aus Kliniken und ihrer Datenbank bestätigt. CED als Psoriasis-Begleiterkrankung Eine chronisch entzündliche Darm-Erkrankung gehört zu den typischen Begleiterkrankungen („Komorbiditäten“) der Schuppenflechte. D.h. Menschen mit Psoriasis haben sowieso ein höheres Risiko, daran zu erkranken als die Normalbevölkerung. Professor Jörg Prinz berichtete, dass 9,6 bis 11 Prozent der Psoriatiker gleichzeitig an Morbus Crohn leiden. Vom Colitis ulceros seien 5,7 Prozent der Menschen mit Schuppenflechte betroffen [2]. Je schwerer die Psoriasis ist, desto höher ist das Risiko, zusätzlich an einer CED zu erkranken schreibt die AKdÄ. Da Biologika meist bei schwer Betroffenen eingesetzt werden, seien diese Patienten von Anfang an gefährdeter. Wenn dann zusätzlich das Medikament Darmentzündungen fördert, steigt das Risiko einer CED. Kommentar Die Zahl der möglichen Fälle wird von der AKdÄ als unter 1 Prozent genannt. Sie kann aber nur geschätzt sein, weil es zu wenig Daten gibt. Wenn die Zahl zutrifft, gehören die chronisch entzündlichen Darmerkrankungen zu den „gelegentlich“ auftretenden Nebenwirkungen. Das ist nicht „häufig“ oder „sehr häufig“, aber auch nicht „selten“ oder „sehr selten“. Patienten, die mit dieser Wirkstoffgruppe behandelt werden, sollten aktiv werden, wenn sie regelmäßig Darmprobleme haben. Je früher eine CED erkannt wird, desto besser ist sie zu behandeln. Im von der AKdÄ geschilderten Fall wurde der Patient auf Humira (Adalimumab) umgestellt. Unverständlich ist, weshalb diese Warnung nicht (auch) von den weltweit geführten Psoriasis-Registern gekommen ist. Gerade die sind dafür eingerichtet worden, vor allem bisher unentdeckte Nebenwirkungen durch regelmäßige Befragungen festzustellen. Beim deutschen Register PsoBest steht die Frage nach neu aufgetretenen Nebenwirkungen in der Check-Liste des Arztes bzw. seiner Assistentin. Der Patient wird lediglich mündlich danach gefragt. Es ist kaum vorstellbar, dass chronisch entzündliche Darmerkrankungen in den Registern nur deshalb nicht aufgefallen sind, weil „vergessen“ wurde, nach neuen Nebenwirkungen zu fragen. Entweder irrt sich die AKdÄ mit ihrer Einschätzung und es handelt sich um sehr seltene Einzelfälle. Dem widerspricht aber ihre Einschätzung, dass es einen „plausiblen Zusammenhang“ zwischen blockiertem IL-17 und dem Auftreten einer Darmentzündung gibt – an Mäusen bewiesen, an Menschen in Fällen dokumentiert. Oder aber gemeldete Nebenwirkungen werden von den Psoriasis-Registern grundsätzlich anders ausgewertet. So dass zum Beispiel sehr seltene Fälle nicht publiziert werden. Zur kritischen Betrachtung der Arbeit der Psoriasis-Register gehört die Tatsache, dass sie alle "Interessenkonflikte" haben. Sie können ihre Arbeit nur durchführen, weil sie direkt oder indirekt von großen Pharmafirmen mitfinanziert werden. Das hat damit zu tun, dass die Hersteller von Biologika verpflichtet wurden, nach Zulassung die langfristige Wirkung ihrer Präparate zu beobachten. Es ist aber nicht vorgesehen, das von finanziell unabhängigen Einrichtungen dokumentieren zu lassen – also werden unter anderem die Hersteller zur Kasse gebeten. Von pharma-gesponserten Arzneimittel-Studien weiß man, dass deren Ergebnisse durch diese Auftragsforschung verzerrt sind. Damit man bei den Ergebnissen der Psoriasis-Register nicht den gleichen Effekt befürchten muss, sollten sie deutlich machen, wie sie die Unabhängigkeit ihrer Arbeit absichern. Firmen selbst warnen Ärzte mit „Rote-Hand-Briefen“ vor neu erkannten Arzneimittel-Risiken. Aber erst dann, wenn die Zusammenhänge wissenschaftlich bewiesen sind. Eine frühzeitige Warnung, wie sie die AKdÄ ausgesprochen hat, ist eher selten. Als betroffener Patient erwartet man, dass selbst bei Verdachtsfällen vorsorglich auf mögliche Nebenwirkungs-Risiken hingewiesen wird. Selbst auf die Gefahr hin, dass manche Menschen bei neu entdeckten Arzneimittel-Nebenwirkungen schnell panisch reagieren. Jeder kann für sich entscheiden: Wie groß ist das Risiko? Wie stark sind die Nebenwirkungen im Verhältnis zur Besserung der Schuppenflechte? Und wie gut kann die moderne Medizin mit diesen Nebenwirkungen umgehen? Quelle: "Induktion und/oder Demaskierung von chronisch-entzündlichen Darmerkrankungen unter Secukinumab (Cosentyx®)", Deutsches Ärzteblatt | Jg. 115 | Heft 14 | 6. April 2018 [1] Sie besteht aus fünf verschiedenen Botenstoffen: IL-17A bis IL-17F. Die veranlassen, dass verstärkt Hautzellen (Keratinozyten) gebildet und Entzündungen ausgelöst werden. Das Signal dazu wird aber nur weitergeleitet, wenn der Botenstoff an einen Rezeptor andockt. IL-17 passen nur in IL-17-Rezeptoren, wie ein Schlüssel in ein Schloss. Während Secukinumab und Ixekizumab verhindern, dass sich überhaupt IL 17A bilden, blockiert Brodalumab die IL-17-Rezeptoren. IL-17A und weitere aus der IL-17-Familie finden keine freien Rezeptoren. Dadurch werden ihre Botschaften nicht weitergeleitet. [2] „Ursachen der Psoriasis“, Vortrag am 15. September 2017 in Bad Reichenhall, Patientenveranstaltung der PSOAG Tipp zum Weiterlesen Bei manchen Biologika können Hefepilze zum Problem werden (Pharmazeutische Zeitung, 11.01.2022) Einige Biologika können dafür sorgen, dass der Körper der Hefepilze nicht mehr Herr wird. Das sollten alle wissen haben, die diese Biologika anwenden. Nicht in Panik verfallen, aber eben im Hinterkopf haben. In diesem Artikel heißt es: Um das in die gängigen Medikamentennamen zu übersetzen: IL-17-Hemmer sind zum Beispiel Cosentyx, Taltz, Kyntheum und Bimzelx. Ein IL-12/23-Hemmer ist zum Beispiel Stelara. Tremfya, Ilumetri und Skyrizi hemmen "nur" IL-23.- 2 Kommentare
-
- Brodalumab
- Colitis ulcerosa
- (und 7 mehr)
-

Interessante Artikel zum Thema Psoriasis, Soziales und Recht
Redaktion erstellte ein Artikel in Magazin
Hier weisen wir auf Artikel hin, die rund um das Thema Schuppenflechte interessant sein könnten, wenn es um soziale Aspekte oder um rechtliche Fragen geht. Pharmafirma muss über Nebenwirkungen Auskunft geben (Beck aktuell, 27.01.2014) Ein Kläger hatte nach der Einnahme eines Gicht-Medikamentes schwere Nebenwirkungen bemerkt. Er musste vor Gericht durchsetzen, dass die Firma über ihr bekannte Nebenwirkungen Auskunft geben muss. Ein Streitpunkt war offenbar, ob der Kläger den Zusammenhang zwischen Medikament und Nebenwirkung beweisen muss. Muss er nicht - es genügt laut Oberlandesgericht, dass der Zusammenhang plausibel ist. Wie man die Vorsorgevollmacht frühzeitig regelt (NDR, 09.01.2012) Viele glauben, ein Familienmitglied vertreten zu können, wenn es nicht mehr geschäftsfähig ist. Das ist jedoch ein Irrtum. Eine Vorsorgevollmacht kann Sicherheit geben. Jobcenter muss nicht für frei verkäufliche Mittel aufkommen (Deutsche Apotheker-Zeitung, 01.11.2011) Patienten mit Hartz IV erhalten von ihrem Jobcenter zusätzlich zu ihrer Regelleistung keinen Mehrbedarf wegen der Kosten für nicht-verschreibungspflichtige Arzneimittel. Das bestätigte jetzt ein Gericht. Hartz IV: Jobcenter müssen PKV voll bezahlen (Deutsche Aidshilfe, 19.01.2011) Die Jobcenter müssen die Krankenkassenbeiträge für privat versicherte Hartz-IV-Empfänger in voller Höhe übernehmen. Das hat das Bundessozialgericht jetzt entschieden.-
- Behinderung
- Beruf
-
(und 5 mehr)
Markiert mit:
-

Cosentyx – was ist das und wie wird es angewendet?
Claudia Liebram erstellte ein Artikel in Secukinumab (Cosentyx)
Cosentyx ist ein Medikament zur Behandlung der Schuppenflechte und der Psoriasis arthritis. Der Wirkstoff in Cosentyx heißt Secukinumab. Cosentyx gehört zur Gruppe der so genannten Biologika. Diese Stoffe heißen so, weil sie von lebenden Zellen hergestellt werden – das „Bio“ kommt also von Biologie (und nicht von „Bio“ wie im Lebensmittelmarkt). Bei Cosentyx handelt es sich um einen gentechnisch hergestellten humanen Antikörper gegen Interleukin-17A. Hersteller ist die Firma Novartis. Bei welcher Erkrankung wird Cosentyx angewandt? Cosentyx ist seit Januar 2015 zugelassen für die Behandlung einer Plaque-Psoriasis, die mittelschwer bis schwer ist. Außerdem ist es seit November 2015 zugelassen zur Behandlung von Psoriasis arthritis und ankylosierender Spondylitis (Morbus Bechterew). Wirkungsweise von Secukinumab Secukinumab ist ein humaner monoklonaler Antikörper, der das Interleukin-17A (IL-17A) neutralisiert. Es verhindert die Ausschüttung von entzündungshemmenden Zytokinen, Chemokinen und Mediatoren. Ist genug Secukinumab im Körper, erreicht es die Haut – und reduziert dort lokale Entzündungsmarker. Rötung, Verhärtung und Schuppung der Psoriasis-Stellen werden vermindert. IL-17A kommt im Körper eines Menschen natürlich vor. In gesundem Maße ist es an den üblichen Antworten auf Entzündung und Immunsystem beteiligt. Bei Plaque-Psoriasis aber kommt in den Schuppenflechte-Stellen zu viel IL-17A vor. Wie wird Cosentyx angewandt? Die Therapie sollte ein Arzt begleiten, der mit der Therapie der Schuppenflechte und / oder der Psoriasis arthritis einige Erfahrung hat. Cosentyx wird als Spritze oder als Pen verabreicht und subkutan – also unter die Haut – gespritzt. Das kann der Patient selbst tun, wenn er Erfahrung mit der Selbst-Injektion hat. Dabei sollte die Injektion aber möglichst nicht in Bereiche der Haut gesetzt werden, die von Psoriasis befallen sind. Dosis bei Schuppenflechte Empfohlen wird bei Schuppenflechte eine Dosis von 300 Milligramm Secukinumab. Seit Februar 2021 ist dafür nur noch die Anwendung eines einzelnen Pens oder der Spritze nötig. Zuvor musste man sich immer zwei Spritzen setzen. Cosentyx wird im ersten Monat einmal pro Woche gespritzt, danach alle vier Wochen. Wirkt das Medikament nach 16 Wochen nicht oder nicht ausreichend, sollten Arzt und Patient über ein Absetzen der Therapie sprechen. Wer mehr als 90 Kilogramm wiegt, kann Cosentyx auch alle zwei Wochen spritzen. Diese Dosierung wurde im Frühjahr 2022 zugelassen. Dass dieser Spritzen-Abstand eine Verbesserung bringen kann, wurde in einer Studie belegt. Dosis bei Psoriasis arthritis In einer Mitteilung zur Zulassung bei Psoriasis arthritis verwies der Hersteller Novartis auf eine Studie, in der bei 84 Prozent der Patienten mit Psoriasis arthritis die Gelenkzerstörung aufgehalten worden sei. Erste Erfolge in der Behandlung hätten sich nach ein bis drei Wochen gezeigt. Sie hätten auch nach zwei Jahren noch angehalten. Laut Zulassung wird Cosentyx bei Psoriasis arthritis in der Dosierung von 150 mg in den ersten vier Wochen wöchentlich gespritzt. Danach geht es einmal im Monat weiter. Wer neben der Psoriasis arthritis noch eine mittelschwere bis schwere Schuppenflechte hat oder auf TNF-alpha-Blocker nicht reagiert, kann die doppelte Dosis nehmen: Dann sind 300 mg pro Anwendung möglich. Dosis bei Kindern Kinder mit Schuppenflechte können ab einem Alter von 6 Jahren Cosentyx anwenden. Die empfohlene Dosis für Kinder bis 50 Kilogramm Gewicht ist eine Injektion mit 75 Milligramm Secukinumab. Alle Kinder, die schwerer als 50 Kilogramm sind, sollen eine 150-Milligramm-Injektion bekommen. Wenn die Wirkung dann noch nicht genügend ist, kann die Dosis auf 300 Milligramm erhöht werden. Wann darf Cosentyx nicht eingenommen werden? Betroffene, die eine chronische Infektion oder eine immer wieder auftretende Infektion hatten oder haben, sollten mit Cosentyx eher vorsichtig sein. Eine klinisch relevante, aktive Infektion gehört zu den Gegenanzeigen – spricht also gegen die Anwendung von Cosentyx. Das Gleiche gilt für Patienten mit aktiver Tuberkulose. Wer eine latente Tuberkulose hat, sollte vor Beginn der Therapie eine Anti-Tbc-Therapie machen. Noch deutlicher vorsichtig sollten Betroffene mit Morbus Crohn sein. In den Studien vor der Zulassung von Cosentyx traten Exazerbationen der Darmerkrankung auf – teilweise sogar mit schweren Fällen. Das geschah sowohl bei denen, die den Wirkstoff bekamen, als auch bei denen, die ein Placebo-Medikament erhielten. Schwangerschaft und Stillzeit Nein, im Gegenteil: Frauen im gebärfähigen Alter sollten während der Behandlung verhüten – und mindestens 20 Wochen danach. Zwar gab es in Tierversuchen keine direkten oder indirekten Schäden auch nicht am Embryo, bei der Geburt oder danach, dennoch sollte eine Schwangerschaft vermieden werden. Ebenso unbekannt ist, ob Cosentyx in die Muttermilch übergeht. Für die Auswirkung von Secukinumab auf die Zeugungsfähigkeit gibt es keine Untersuchungen. In Experimenten mit Tieren gab es keine nachteiligen Wirkungen in diesem Bereich. Mögliche Nebenwirkungen Sehr häufige Nebenwirkungen (bei einem von 10 Behandelten oder mehr) Infektionen der oberen Atemwege Häufige Nebenwirkungen (bei mehr als einem von 100 Behandelten aber weniger als bei einem von 10) Herpes im Mund (Oraler Herpes) Nasenlaufen (Rhinorrhö) Durchfall (Diarrhö) Gelegentliche Nebenwirkungen (bei mehr als einem von 1000 Behandelten, aber weniger als bei einem von 100) Nesselsucht (Urtikaria) Hefepilz-Infektion im Mund (Orale Candidose) Fußpilz (Tinea pedis) Entzündung des Gehörgangs (Otitis externa) Verminderung der neutrophilen Granulozyten im Blut (Neutropenie) Entzündung der Bindehaut (Konjunktivitis) Seltene Nebenwirkungen Rötung und Abschälung größerer Bereiche der Haut. Kann juckend oder schmerzhaft sein (exfoliative Dermatitis) Weitere Nebenwirkungen Seltene Fälle von anaphylaktischen Reaktionen Zunahme mukosaler od. kutaner Candidosen (leichte bis mittelschwere, nicht schwerwiegende Fälle) Mukokutane Candidose (einschl. ösophageale Candidose) Wechselwirkungen von Secukinumab Lebensimpfstoffe sind während der Behandlung mit Cosentyx tabu. Mit inaktivierten Impfstoffen oder Totimpfstoffen kann dagegen immunisiert werden. Unklar ist, wie sicher und wirksam Cosentyx ist, wenn man es mit Immunsuppressiva oder eine Lichttherapie kombiniert. Darum ging es in den Studien nicht. Was sollte man sonst noch wissen? Latex-Allergiker sollten vorsichtig sein: Die Kappe zum Schutz der Nadel enthält einen Abkömmling von Naturlatex. Überempfindlichkeitsreaktionen können vom Hersteller nicht ausgeschlossen werden. Wie bei allen Biologics sind es vor allem Infektionen, auf die Patient und Arzt achten sollten. Bei den Studien zur Zulassung von Cosentyx waren überwiegend die oberen Atemwege von Infektionen betroffen. Neu im „Sortiment“ der möglichen Nebenwirkungen ist dagegen eine Pilzinfektion der Mundschleimhaut ("mukokutane Candida-Infektionen“). Weniger als 1 Prozent der Teilnehmer in Studien mit Cosentyx entwickelten Antikörper gegen Secukinumab. Die Hälfte davon wiederum waren neutralisierende Antikörper. Dennoch wurden weder ein Verlust der Wirkung noch Unstimmigkeiten beim Abbau des Wirkstoffs im Körper beobachtet. Lagerung Cosentyx kommt in einer Einmalspritze oder in einem Pen aus der Apotheke. Es sollte nicht geschüttelt werden (im Übrigen auch nicht gerührt). Und: Es gehört in den Kühlschrank bei 2 bis 8 °C, nicht aber ins Tiefkühlfach. Das Medikament sollte im Karton bleiben, damit es vor Licht geschützt wird. 20 Minuten vor der Anwendung sollte Cosentyx aus dem Kühlschrank genommen werden. Empfohlen wird ein Blick auf den Inhalt. Der sollte klar sein, kann auch schon mal etwas gelblich sein. Ein Luftbläschen darin ist auch noch normal. Nicht normal sind deutlich sichtbare Teilchen (Partikel), eine trübe Flüssigkeit oder gar eine braune Färbung. Fällt der Spritzen-Termin einmal in eine Reise, hält Cosentyx vier Tage bei Raumtemperatur durch. Danach muss es aber wieder in den Kühlschrank. Kosten Eine Packung Cosentyx mit einer Spritze oder einem Pen à 300mg Secukinumab kostet etwa 1990 Euro (Stand Juli 2021). Das ist ein Listenpreis. Er kann durch spezielle Verträge oder andere Umstände anders sein. Die Angabe dient nur als ungefährer Anhaltspunkt. Eine Packung mit zwei Spritzen oder zwei Pens à 150 mg kostet genauso viel. Die Kosten werden von den gesetzlichen Krankenkassen übernommen, wenn der Arzt die Anwendung von Cosentyx für geboten hält. Preisentwicklung am Beispiel einer Packung mit einem Fertigpen mit 300 mg/2 ml Juli 2021: 1990 Euro (2 Pens a 150ml) Mai 2024: 1989,36 Euro Betreuungsprogramm Der Hersteller Novartis bietet für Patienten, die Cosentyx nehmen, zwei Telefonnummern an: Telefon 01802 232300 (Medizinischer Info-Service) Telefon 0800 26 73 690 (Servicecenter für Patienten mit Schuppenflechte oder Psoriasis arthritis) Beim Servicecenter kann man auch eine Kühltasche für den Transport des Medikamentes von der APotheke nach Hause bestellen. Verwendete Literatur Fachinformation Angaben des Herstellers "Secukinumab in Plaque Psoriasis — Results of Two Phase 3 Trials" in: The New England Journal of Medicine, 14. Juli 2014 Mehr zum Thema In unserem Forum berichten Anwender über ihre Erfahrungen mit Cosentyx. Erklärung und Bewertung des Wirkstoffs vom Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG) zur Anwendung bei Schuppenflechte (Psoriasis) Studiendaten zu Cosentyx In den letzten Studien mit dem Wirkstoff Secukinumab vor dessen Zulassung hatten 70 Prozent der Teilnehmer eine Verbesserung ihrer Plaque-Psoriasis um 90 oder 100 Prozent erreicht. 100 Prozent Verbesserung ist dabei gleichbedeutend mit einer kompletten Erscheinungsfreiheit. Angewendet wurde dabei 16 Wochen lang eine Dosis von 300 Milligramm gekommen. Laut Hersteller zeigte sich sein Medikament dem Biologics-"Klassiker" Enbrel überlegen. Nach zwei Wochen soll die Psoriasis bereits um die Hälfte reduziert worden sein – was bei Enbrel erst nach sieben Wochen der Fall gewesen sei. Studie 1 ("ERASURE") Eine Verbesserung der Psoriasis um 75 Prozent erreichten nach 12 Wochen 81,6 Prozent der Patienten mit 300 Milligramm Secukinumab 71,6 Prozent der Patienten mit 150 Milligramm Secukinumab 4,5 Prozent der Patienten mit einem Placebo Studie 2 ("FIXTURE") Eine Verbesserung der Psoriasis um 75 Prozent erreichten nach 12 Wochen 77,1 Prozent der Patienten mit 300 Milligramm Secukinumab 67,0 Prozent der Patienten mit 150 Milligramm Secukinumab 44,0 Prozent der Patienten mit Etanercept 4,9 Prozent der Patienten mit einem Placebo In einer Studie in Phase IIIb ("CLEAR") war Cosentyx nach Angaben des Herstellers wirksamer als Stelara (Wirkstoff: Ustekinumab). In weiteren Studien wurde untersucht, wie der Wirkstoff speziell auf eine Psoriasis an den Händen und Füßen, auf Nagelpsoriasis und bei einer Pustulosa an Händen und Füßen wirkt. Kurz gemeldet Dezember 2024: In einer Studie wurde untersucht, wie Cosentyx "in der freien Wildbahn" angewendet wird – also außerhalb von Studienzentren. Die Studie trägt die Abkürzung PROMPT. Das Fazit: Sprich: In den klinischen Studien bekamen auch Leute mit nicht ganz so starker Psoriasis das Medikament. Sie hatten vorher noch nicht so viel Erfahrung mit Biologika – und sie wogen weniger. [Quelle 1 und Quelle 2] Oktober 2023: In den USA kann Cosentyx nun auch in einer intravenösen Version angewendet werden – also als Infusion. Das gilt für die Behandlung von Psoriasis arthritis, von Morbus Bechterew und von Nicht-radiologischer axialer Spondyloarthritis (nr-axSpA). Die Dosis wird je nach Gewicht angepasst. Kontrolluntersuchungen sollen nicht notwendig sein. Die Infusion wird beim Arzt verabreicht und dauert 30 Minuten. [Quelle] Oktober 2022: Cosentyx hat bei Enthesitis-assoziierter Arthritis und bei juveniler (kindlicher) Psoriasis arthritis keinen Zusatznutzen gegenüber anderen Therapien. Das hat das Institut für Qualität und Wirtschaftlichkeit in der Medizin, kurz Iqwig, befunden. Der komplizierte Vorgang dieser Bewertung wird vom Iqwig hier erklärt. Am Ende geht's um Geld. Wenn kein Zusatznutzen belegt ist, kann der Hersteller eines Medikaments für gewöhnlich nicht mehr Geld für sein Produkt verlangen als vergleichbare Therapien kosten. [Quellen: Bewertung bei Enthesitis-assoziierter Arthritis bzw. bei juveniler Psoriasis arthritis] September 2022: Cosentyx-Hersteller Novartis bekam "Besuch" von Beamten der schweizerischen Wettbewerbsbehörde. Laut "laborjournal" ging es um rechtswidrige Sperr-Patente bei Cosentyx, die die Firma eingesetzt haben soll. [Quelle] März 2022: Bei Erwachsenen, die mehr als 90 Kilogramm wiegen, kann eine Umstellung auf eine Injektion alle zwei Wochen (statt vier) die Psoriasis verbessern. [Quellen: hier und hier] Februar 2021: Der Hersteller hat die Zulassung für einen Pen und eine Spritze mit 300 Milligramm Secukinumab bekommen. Die Anwender dieser höheren Dosis müssen dann künftig nicht mehr zwei Injektionen spritzen. [Quellen: hier und hier] Dezember 2020: In einer Studie wurde verglichen, ob Cosentyx und Stelara bei Patienten im realen Leben genauso gut wirken wie in den Studien vor der Zulassung. Tun sie nicht. [Quelle] Aber (von uns): Die Studienbedingungen sind bei den Zulassungsstudien eben ideal. Der schnöde Alltag bringt diese und jene Störfeuer mit sich, das die Wirkung beeinträchtigen kann. Juli 2020: Kinder ab 6 Jahren mit einer mittelschweren bis schweren Schuppenflechte können jetzt auch mit Cosentyx behandelt werden. [Quelle] November 2019: In einer Studie sollte gezeigt werden, ob Cosentyx bei Psoriasis arthritis deutlich besser wirkt als Humira. Hat nicht geklappt – rein statistisch, wie der Konzern erklärt. Das Ergebnis sei dennoch ermutigend. Oktober 2019: Hersteller Novartis verkündet, dass Cosentyx inzwischen das umsatzstärkste Medikament des Konzerns ist und der Erlös aus dem Geschäft damit gestiegen ist. Deshalb erhöht er seine Prognose für Umsatz und Gewinn. Juli 2019: Eine seltene Nebenwirkung kommt neu in den Beipackzettel: die Rötung und Abschälung der Haut größerer Körperpartien, die juckend oder schmerzhaft sein kann. Der Fachausdruck heißt exfoliative Dermatitis. Mai 2019: In einer Studie wurden verschiedene Spritzen-Intervalle untersucht. Das Ergebnis: Die 300-mg-Dosis alle vier Wochen ist die erfolgsversprechendste. Aber: Für Anwender, die mehr als 90 kg wiegen und nach 24 Wochen noch keine 90-prozentige Besserung ihrer Schuppenflechte bemerkt haben, könnte ein Spritzenintervall alle zwei Wochen nützlich sein. (Quelle: British Journal of Dermatology) November 2018: Die Dosierung von Cosentyx darf bei Psoriasis arthritis flexibler sein. Der Hersteller bekam grünes Licht, das künftig auch in die Packungsbeilage zu schreiben. (Quelle: cash.ch und andere) Juni 2018: In den USA darf der Hersteller nun in den Beipackzettel schreiben, dass Cosentyx auch die Zerstörung der Gelenke aufhalten kann. (Quelle: Pressemitteilung von Novartis) Mehr über Cosentyx -
Das Paul-Ehrlich-Institut hat eine Datenbank mit Verdachtsfällen von Impf-Komplikationen ins Internet gestellt. In der Datenbank kann gezielt nach bestimmten Reaktionen auf Impfstoffe recherchiert werden. So einige Male taucht auch die Psoriasis bei den Komplikationen nach einer Impfung auf. Das Institut ist unter anderem für die Zulassung und Prüfung von Impfstoffen zuständig. Es stellt damit als erste Arzneimittelzulassungsbehörde in Europa Daten zu Verdachtsfällen auf Impfnebenwirkungen in dieser Form frei zur Verfügung. Hintergrund ist die Sorge vieler Bürger über reale und vermeintliche Risiken bei Impfungen. Die Schattenseite dieser Furcht nämlich: Eine nachlassende Akzeptanz von Impfungen führt zu sinkenden Impfraten und birgt die Gefahr eines erneuten Anstiegs dieser Krankheiten. Die Klickaarbeit ist leider beträchtlich, wenn man über die Startseite www.pei.de/db-uaw geht. Wenn Sie nach der mehrseitigen Erläuterung angelangt sind, geht es so weiter: 1) Markieren von "Gastkonto" 2) Klick auf "Anmelden" 3) Klick auf "Suchen" (oben) 4) Eingeben von Text bei "gemeldete Reaktion(en)" oder - wenn bekannt - beim "Arzneimittel/ Impfstoff". Beispielsweise Eingeben von "Psoriasis" bei "gemeldete Reaktion(en)" 5) Nochmal klicken auf "Suchen" (oben) Impfungen sind für Psoriatiker nicht grundsätzlich tabu. Fragen Sie Ihren Haus- oder Hautarzt! Quelle: dpa, 07.05.2007
-
- Erfahrungen
- Impfung
-
(und 1 mehr)
Markiert mit:
-
Yuflyma: Wie lange und wie ist das mit Nebenwirkungen?
Josselyne erstellte einem Thema in Schuppenflechte-Forum
Guten Tag,Ich habe bis Jetzt eine Behandlung mit MTX gehabt. Nach Zwei Jahre hilft es fast nichs mehr. Meine Hautarzt empfiehlt eine Behandlung mit Yuflyma. Wie lang kann Mann diese Mittel ansetzen.Es sind sehr viel Nebenwirkung beschrieben.Was ist eure Erfahrung damit ?Danke- 1 Antwort
-
- Adalimumab
- Erfahrungen
-
(und 2 mehr)
Markiert mit:
-
Hallo zusammen, ich habe eine Frage zu Tremfya. Ich hatte letzten Winter die Pso so heftig, wie verbrannte Haut, und mein Arzt hat mir dann Tremfya gespritzt. Nach 4 Wochen dann die 2. Spritze. Es war unglaublich, alles weg :-). Allerdings hatte ich 2 wirklich heftige Migräneschübe, die mich komplett ausgeknockt haben. Ausschlag, Magen-Darm-Probleme und am Schlimmsten waren die Kopfschmerzen, 6 Wochen am Stück. Keine Tablette hat wirklich geholfen. Dann war der Spuk von einem Tag auf den anderen vorbei und ich sollte die 3. Spritze bekommen. Mit Absprache meines Hautarztes haben wir die erstmal ausgelassen und ich bekam einen Termin 2 Monate später. Mein Hautarzt glaubte nicht, dass die Kopfschmerzen oder die Migräne Nebenwirkungen von Tremfya waren. Er meinte es liegt am Wetter. Es waren Nebenwirkungen, ich hatte noch nie zuvor Migräne und danach auch nicht mehr. Und auch sonst habe ich selten Kopfschmerzen, mal ein Tag ganz leicht und dann ist es wieder gut. Ok, lange Rede kurzer Sinn. Ich habe mir keine Spritze mehr geben lassen und war jetzt 1 gutes Jahr komplett erscheinungsfrei. Jetzt habe ich ein paar kleine Stellen bekommen und habe mir wieder eine Spritze geben lassen. Der Arzt besteht darauf, dass ich alle 2 Monate Tremfya bekommen soll, und glaubt nicht an Nebenwirkungen. Er war echt ungehalten. Ich verstehe es nicht. Ja es ist eine Therapie, aber warum so viele Spritzen, wenn man mit weniger sehr gut über die Runden kommt ?! Ich war ja über ein Jahr ohne Psoriasis. Hier gibt es doch einige die Erfahrung damit haben, vielleicht kann mir jemand einen Tipp geben. Ich glaube ich ziehe Psoriasis den Dauerkopfschmerzen vor... Liebe Grüße, Alexandra
- 7 Antworten
-
- Nebenwirkungen
- Schuppenflechte
-
(und 1 mehr)
Markiert mit:
-
Hallo, Ich nehme nun seit 3 Monaten MTx 15 mg und seit einigen Wochen ist meine Haut wirklich schlimm geworden. Ich habe immer mal wieder pickel, aber das zur Zeit ist wirklich extrem. So viele entzündete, große Pickel. Nun habe ich mal geschaut und siehe da: Akne ist als Nebenwirkung von MTX aufgeführt. Hat das auch schon mal jemand gehabt und wenn ja, hat irgendwas da Abhilfe geschafft? Ich bin echt frustriert, das MTX scheint bei mir gar nicht zu helfen, habe zur zeit auch noch einen ordentlichen Schub und dann auch noch sowas. Den nächsten Termin bei meiner Rheumatologin habe ich erst Mitte Februar und derzeit ist sie im Urlaub. LG von einer frustrierten Feling, die gerne auch mal was positives schreiben würde.
- 6 Antworten
-
- MTX
- Nebenwirkungen
-
(und 2 mehr)
Markiert mit:
-
Sisa ist eigentlich immer gut drauf - eigentlich. Aber: Sie hat Schmerzen. Sie sucht Gleichgesinnte zum Reden. Der Erfahrungsbericht einer Betroffenen. Ich habe seit meinem 16. Lebensjahr Schuppenflechte. Vor Jahren (nach der Geburt meines 2. Kindes) hat man bei mir Psoriasis-Arthritis in den Kreuzdarmbeingelenken festgestellt. Seitdem habe ich schon alles mögliche ausprobiert. Rheumamittel, die überhaupt nicht angeschlagen haben. Dann zum Schluss MTX. Einmal die Woche bekam ich 15 mg gespritzt. Ging fast 1 Jahr gut. Dann bekam ich aufgrund des MTX eine CMV-Infektion mit Begleit-Hepatitis. Meine Blutwerte waren im Keller und ich war sehr stark immunsuppremiert. Lag lange Zeit im Krankenhaus. Dann bekam ich eine Harnwegsinfektion nach der nächsten, Fieberschübe, sehr stark vergrößerte Milz, hohe Leberwerte, etc. Das MTX musste abgesetzt werden. Dann gingen die Schübe der Arthritis wieder los. Schmerzen ohne Ende. Habe mich irgendwie mit Schmerzmittel über Wasser gehalten. Tramadol habe ich jetzt zum Schluss genommen, musste ich aber immer erbrechen, was auch ganz toll war. Ja, ich bin im Moment sehr frustriert. War heute beim Rheumatologen. Er hat mir gesagt, dass meine Knochen schon sehr stark zerstört wären. Er gab mir eine Cortison-Spritze, wir wollen es mit MTX auch wieder versuchen. Die Cortison-Spritze hat bei mir komischerweise gerade das Gegenteil bewirkt. Ich habe Schmerzen ohne Ende und kann kaum laufen, geschweige denn sitzen oder liegen. Ich habe das Gefühl, dass im Moment alles schief läuft in meinem Leben, und ich wäre sehr dankbar, mit jemandem Gleichgesinnten reden zu können. Ich bin eigentlich ein Optimist, habe sehr viel Humor und bin immer gut drauf. Die Menschen in meiner Umgebung wissen gar net, wie schlecht mirs manchmal geht. Ich versuche einfach, das Beste daraus zu machen und mit dieser Krankheit zu leben. Gruß Sisa (Mai 2003)
-
- Erfahrungsberichte
- Nebenwirkungen
-
(und 1 mehr)
Markiert mit:
-

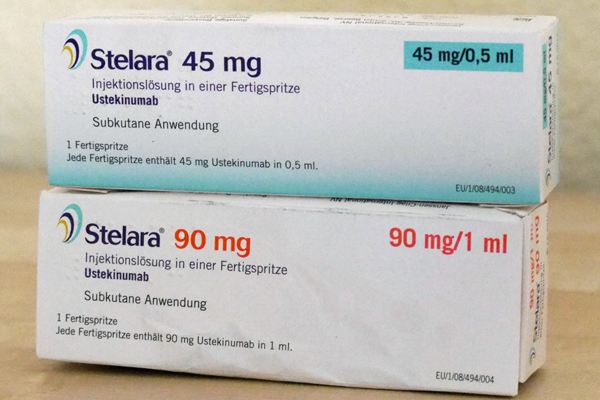
Warnung vor seltener Nebenwirkung bei Stelara (Ustekinumab)
Rolf Blaga erstellte ein Artikel in Ustekinumab
Am 21. November 2014 hat der Hersteller von Stelara einen so genannten „Rote-Hand-Brief“ für die Ärzte herausgegeben. Während der Behandlung mit dem Biologikum kann in seltenen (!) Fällen eine exfoliative Dermatitis (Erythrodermie) auftreten. Auch eine nicht entzündliche Exfoliation der Haut wurde gelegentlich bei Psoriasis-Patienten während der Ustekinumab-Behandlung beobachtet. Bei einer exfoliativen Dermatitis rötet sich die Haut auf mehr als 90 Prozent der Oberfläche, sie "pellt" sich ab. Aber: Auch die Psoriasis an sich kann plötzlich "explodieren" – sich über den ganzen Körper ausbreiten und zu einer Erythrodermie werden. Beides äußert sich als schwere, großflächige Entzündung auf der Haut. Das Problem: Die Symptome sind äußerlich nicht zu unterscheiden. Bei ersten Anzeichen einer großflächiger Entzündung und / oder einer großflächigen Pellung der Haut sollten Patienten sofort zum Arzt zu gehen und sich behandeln zu lassen – auch ohne Termin. Das Biologikum Ustekinumab kann bei mittelschwerer und schwerer Plaque-Psoriasis sowie bei einer aktiven Psoriasis arthritis verschrieben werden. In Deutschland ist es seit 2009 zugelassen. Jetzt wurde bekannt, dass in mehreren Fällen weltweit diese schwere Entzündung aufgetreten ist. Kurz nach der Ustekinumab-Injektion verschlechterte sich die Psoriasis plötzlich. Die Haut am gesamten Körper war stark gerötet und brannte. Die Entzündung war oft mit Fieber verbunden. Wenn das nicht möglichst frühzeitig mit Kortison behandelt wird, kann es zu Infektionen, Nährstoffverlusten und Flüssigkeitsmangel kommen. Die exfoliative Dermatitis ist eine ernsthafte Erkrankung, die jedoch relativ selten auftritt. Einige dieser Stelara®-Patienten mussten im Krankenhaus behandelt werden. Der Hersteller Janssen-Cilag gibt an, bei Stelara® sei das Risiko „selten“ – das heißt, 0,01 Prozent bis maximal 0,1 Prozent der Patienten müssten damit rechnen. Die nicht entzündliche Exfoliation der Haut käme dagegen schon „gelegentlich“ vor – das heißt in 0,1 Prozent bis höchstens 1 Prozent der Fälle. Alle uns bekannten Nebenwirkungen finden sich im Artikel "Stelara – was ist das und wie wird es angewendet?" Kommentar Alle Biologika sind Medikamente für ansonsten schwer therapierbare Fälle. Aber es sind, wie auch bei ähnlich stark wirksamen Medikamenten gegen andere Krankheiten, schwere Nebenwirkungen möglich. Für Deutschland hat Professor Kristian Reich das Register PsoBest ausgewertet. Es wurde ermittelt, wie sich Psoriasis-Medikamente in ihren Nebenwirkungen unterscheiden. Die Daten aller registrierten Patienten wurden verglichen. Das Ergebnis ist für Ärzte wie für die große Mehrheit der Patienten beruhigend: Es gibt keine auffälligen Unterschiede zwischen den konventionellen Medikamenten (Fumarsäureester, Methotrexat, Ciclosporin) und den Biologika. Alle schwerwiegenden Ereignisse lagen unter 1 Prozent. In den USA, aber auch in den Zulassungsstudien waren schwere Nebenwirkungen häufiger. Nur bei den Infekten lagen die Biologika etwas höher als die anderen Medikamente. Krebs als seltene Nebenwirkung war bei allen innerlichen Medikamenten möglich, bei den Biologika nur Hautkrebs. Natürlich möchte niemand zu den wenigen gehören, die eine schwere Nebenwirkung bekommen. Man muss offen sagen, dass das nicht vorhersehbar ist. Patient und Arzt können nur sehr aufmerksam die Symptome beobachten und diszipliniert die vorgeschriebenen Blutuntersuchungs-Termine einhalten. Im Endeffekt muss jeder für sich selbst entscheiden, ob er sich auf ein entsprechend starkes Medikament einlässt, das wirken kann oder nicht und das schwere Nebenwirkungen haben kann.- 13 Kommentare
-
- Biologika
- Nebenwirkungen
-
(und 1 mehr)
Markiert mit:
-

Raptiva – vom Aufstieg und Niedergang eines Medikamentes
Claudia Liebram erstellte ein Artikel in Tabletten und Spritzen
Raptiva wurde von Genentech zusammen mit Xoma entwickelt. Genentech ist eine Tochterfirma von der Roche. Die Firma Serono wiederum hat die Vertriebsrechte außerhalb der USA und Japans. In den USA erhielt das Medikament Raptiva die Zulassung für die Behandlung einer mittelschweren bis schweren Plaque-Psoriasis bei erwachsenen Patienten im Oktober 2003. In der Schweiz war es am 16. März 2004 so weit. Die EU-Zulassung erfolgte im September 2004. Das Biotech-Medikament konnte bei erwachsenen Patienten mit einer mittelschweren bis schweren chronischen Plaque-Psoriasis eingesetzt werden, wenn andere innerliche Medikamente oder eine Bestrahlungstherapie nicht oder nicht genügend anschlugen oder aus irgendeinem anderen Grund nicht in Frage kamen. Raptiva war damals das zweite sogenannte "Biological" (biotechnisch hergestellte Medikament), das in den USA zugelassen wurde. Das erste war dort Amevive® mit dem Wirkstoff Alefacept. Im Juni 2004 empfahl dann der Expertenausschuss der europäischen Arzneimittelbehörde EMEA, das Medikament Raptiva zur Behandlung der Psoriasis zuzulassen. Der Antrag von Serono stammte aus dem Februar 2003. Die positive Beurteilung des CHMP bezog sich auf die Behandlung von erwachsenen Patienten mit mittelschwerer bis schwerer chronischer Plaque-Psoriasis, die nicht auf innerliche Therapien ansprechen oder bei denen diese aus irgendwelchen Gründen nicht möglich sind – zum Beispiel, weil sie andere systemische Therapien wie Ciclosporin, Methotrexat und PUVA nicht vertragen. Ergebnisse aus Studien Die Ergebnisse von zwei klinischen Studien mit dem Biotech-Medikament waren schon vor der Zulassung bekannt geworden: Erwachsene mit mittelschwerer bis schwerer Plaque-Psoriasis wurden damit behandelt. Untersucht wurden Sicherheit und Wirksamkeit der Behandlung. In Chicago traf sich Ende Juli 2003 die Amerikanische Akademie für Dermatologie. Dort wurden auch die Studienergebnisse verkündet. Studie 1 Zwölf Wochen lang waren 368 Betroffene untersucht worden, nachdem sie zuvor Raptiva oder ein Placebo - ein Schein-Medikament ohne Wirkstoff - bekommen hatten. Teilweise waren die Patienten nach 12-wöchiger Behandlung mit Raptiva zusätzlich bis zu zwölf Wochen lang mit einem Milligram Raptiva pro Kilogramm Körpergewicht behandelt worden. Bei 44 Prozent davon hatte sich die Psoriasis nach 24 Wochen um mehr als 75 Prozent zurückgezogen. Nach der Hälfte der Zeit - also nach 12 Wochen - waren es "nur" 27 Prozent gewesen. Das heißt: Je länger Raptiva angewendet wird, um so besser wirkt es. Bei 15 Prozent der Patienten ging die Psoriasis sogar um 90 Prozent zurück. In der verlängerten Behandlungsphase traten keine Nebenwirkungen auf, die es nicht schon in den ersten zwölf Wochen gab. Da waren es meist nicht-spezifische Infektionen, Kopfschmerzen und Arthritis. Von Nebenwirkungen berichteten insgesamt fünf Prozent der Teilnehmer. Die folgende Tabelle zeigt den Zahlenwust einmal anders: Nach Woche Rückgang des PASI* in % Zahl der Patienten Prozent 12 50 216 59 von 369 12 90 55 15 von 369 24 >50 245 67 von 368 24 75 44 161 von 368 *PASI ist der Psoriasis Area an Severity Index - ein Wert, der die Schwere und Ausdehnung der Psoriasis auf dem Körper angibt. Dabei werden sowohl die flächenmäßige Ausdehnung als auch die Schuppung, die Rötung, die Dicke und Hartnäckigkeit der Stellen berücksichtigt. Mit diesem Wert sollen Therapien vergleichbar werden. Wissenschaftler können dann angeben, dass Therapie X den PASI um 15 Prozent und Therapie Y den PASI um 25 Prozent verbessert. Studie 2 Andere Patienten wurden 12 Wochen lang jede Woche mit zwei Milligramm Raptiva pro Kilogramm Körpergewicht behandelt. Ab der 13. Woche erhielten sie die Hälfte davon pro Woche. Insgesamt hatten die Wissenschaftler diese Patienten 21 Monate lang "unter Kontrolle". Sie sollten zur Verträglichkeit des Mittels Auskunft geben. Dabei ging es um die Sicherheit in der Langzeit-Behandlung. Von diesen Patienten hatte sich die Psoriasis bei 67 Prozent der Patienten um mehr als 75 Prozent gebessert. Patienten, die aus diversen Gründen im Laufe der Studie aus den Untersuchungen ausschieden, wurden dann noch ein letztes Mal bewertet, in den Gesamtzahlen dann aber nicht mehr berücksichtigt. Schlussendlich blieben noch 194 Patienten "bei der Stange". Bei 67 Prozent von ihnen verbesserte sich der PASI um 75 Prozent und mehr. Die Nebenwirkungen waren in dieser Studie stärker - was auch nicht verwundert, denn die Dosis war in den ersten zwölf Wochen doppelt so hoch wie in der erst genannten Studie. In diesen zwölf Wochen klagten Patienten über Kopfschmerzen nicht-spezifische Infektionen (z.B. Erkältungen) Schüttelfrost Schmerzen Übelkeit Kraftlosigkeit und Fieber. Kopfschmerzen, Schüttelfrost, Übelkeit und Fieber sind im Prüfprotokoll vorgegebene Nebenwirkungen, die meist nach den ersten beiden Injektionen von Raptiva auftraten. In der 13. bis 24. Woche berichteten 57 Prozent der Patienten über Nebenwirkungen. Zum Ende der Untersuchungen hin sank die Nebenwirkungsrate auf 47,9 Prozent. Das Auftreten schwererNebenwirkungen war wie auch bei früheren Studien zu Raptiva selten. Nach Woche Rückgang des PASI in % Zahl der Patienten Prozent 84 >75 130 von 194 67 84 >50 167 von 194 86 84 >90 66 von 194 34 Studie 3 Während der "Academy 2005", der Tagung der US-amerikanischen Hautärzte-Vereinigung in New Orleans, stellte die Firma Genentech erste Ergebnisse einer Drei-Jahres-Studie mit Raptiva vor. Die Studie ist die längste, die mit sogenannten Biologics an Psoriasis-Patienten gemacht wurde. Fazit: Die Besserung der Schuppenflechte hält auch nach drei Jahren Behandlung an. Neben den früher schon aufgetretenen Nebenwirkungen sind keine weiteren bekanntgeworden. "Schuppenflechte ist eine chronische Krankheit", berichtete Craig Leonardi, Klinikprofessor an der Uni-Medizinschule in St. Louis. "Als Hautarzt müssen wir die Wirksamkeit und die Sicherheit der verschiedenen Behandlungsoptionen über eine lange Zeit abwägen. "Es ist ermutigend, zu sehen, dass Raptiva über drei Jahre gleichbleibend sicher ist." 36 Monate lang interessierten die Wissenschaftler die Langzeit-Sicherheit und die Wirksamkeit von Raptiva bei Erwachsenen mit mittelschwerer bis schwerer chronischer Schuppenflechte. Nach 33 Monaten waren noch 151 Patienten "übrig", die einmal pro Woche Raptiva bekamen. Das Ergebnis: 75 Prozent von ihnen hatten eine Verbesserung ihrer Psoriasis um 75 Prozent oder mehr (in Zahlen: 131 von 151 Patienten) 41 Prozent von ihnen hatten sogar eine Verbesserung ihrer Psoriasis um 90 Prozent und mehr (in Zahlen: 62 der 151 Patienten) Drei Monate später - am Ende der dreijährigen Studie - waren noch 131 Patienten am Versuch beteiligt. 73 Prozent erreichten eine Besserung ihrer Psoriasis um mehr als 75 Prozent. 40 Prozent erreichten eine Besserung ihrer Psoriasis um mehr als 90 Prozent. Einige wenige Patienten hatten gleichzeitig eine systemische Therapie (innerliche Medikamente) unternommen. In der Ansprechrate gab es keinen deutlichen Unterschied zu anderen Patienten, die "nur" Raptiva bekommen hatten. Beginn und Nebenwirkungen Anfangs bekamen 339 Patienten zwölf Wochen lang einmal wöchentlich Raptiva. Diejenigen, die eine Besserung ihrer Psoriasis um mindestens 50 Prozent aufwiesen, konnten in die Langzeitstudie aufgenommen werden. Sie erhielten nach den zwölf Wochen einmal in der Woche eine sogenannte Erhaltungsdosis von einem Milligramm Raptiva pro Kilogramm Körpergewicht. Insgesamt begannen 290 Patienten diese Phase der Studie. Die Nebenwirkungen unterschieden sich in der Langzeitstudie nicht von denen in den ersten kürzeren Studien: Kopfschmerzen, Infektionen, Schüttelfrost, Schmerzen, Übelkeit, Schwäche und Fieber klangen nach den ersten ein oder zwei Raptiva-Spritzen ab. In den letzten sechs Monaten der Langzeitstudie traten weniger auf. Sie glichen auch da denen in der ersten Phase der Langzeitstudie. Aber: Die sehr guten Ergebnisse sind natürlich darauf zurückzuführen, dass in der letzten Phase der Studie ohnehin nur Patienten waren, die sehr gut auf Raptiva angesprochen hatten. Sie hatten bei der Behandlung der Psoriasis nicht bei Null angefangen. Beginn des Niedergangs Die US-Firma Genentech und die US-amerikanische Behörde zur Zulassung von Medikamenten, die FDA, schrieben am 15. Juli 2005 einen Brief an Ärzte. Darin wurden achdrücklich vor einem Risiko gewarnt, das Raptiva mit sich bringt: Es kann zu einer hämolytischen Anämie kommen. Es handelte sich zu diesem Zeitpunkt um vier Fälle unter 10.000 Patienten. Raptiva barg demnach neben Infektionen auch das Risiko einer Reduzierung der Blutplättchen (Thrombozyten). Außerdem konnte eine hämolytische Anämie auftreten. Diese Art der Anämie tritt auf, wenn das Immunsystem rote Blutkörperchen mit körperfremden Substanzen verwechselt und sie zerstört. Diese hämolytische Anämie trat in vier Fällen auf – zwei während Studien, zwei andere nach der Marktzulassung. Die Nebenwirkungen waren vier bis sechs Monate nach dem Beginn der Behandlung mit Raptiva aufgetreten. Bei Auftreten einer hämolytischen Anämie empfahl Genentech die Einstellung der Behandlung mit Raptiva. Symptome sind schnelle Ermüdung, wenig Energie, schneller Herzschlag insbesondere bei Anstrenung, Anzeichen von Gelbsucht, brauner oder roter Urin und Atemnot. In zwei Fällen sank das Hämoglobin der Patienten auf einen sehr niedrigen Wert. Hämoglobin trägt für gewöhnlich den Sauerstoff zu den Zellen. Unklar war, ob Raptiva an den Nebenwirkungen Schuld ist, doch die Möglichkeit konnte nicht ausgeschlossen werden. Stellungnahme der Firma Serono Medikamente werden, um die Zulassung zu erhalten in klinischen Studien auf ihre Wirksamkeit und Nebenwirkungen getestet. Hier kann aber nur eine begrenzte Anzahl an Patienten eingebunden werden. Seltene Nebenwirkungen bleiben aus statistischen Gründen daher meistens unbeobachtet. Der Gesetzgeber verpflichtet die Pharmaunternehmen daher, in bestimmten Zeitabständen die Zulassungsbehörden über inzwischen neu aufgetretene seltene Nebenwirkungen zu informieren, damit diese dann in die Fachinformation und in den Beipackzettel aufgenommen werden. In den USA werden die Ärzte zeitnah mittels Brief informiert, um diese Nebenwirkung nicht erst nach Drucklegung einer neuen Fachinformation zu erfahren. Genau so verhält es sich in dem vorliegenden Fall der hämolytischen Anämie. Diese Nebenwirkung ist sehr selten und bisher bei 4 von über 10.000 behandelten Patienten aufgetreten. Auch Antibiotika oder gängige Schmerzmittel können zu dieser seltenen Nebenwirkung führen.Im konkreten Fall hat die Firma Genentech, die Raptiva® in den USA vertreibt, das Prozedere eingehalten und die Nebenwirkung an die Arzneimittelbehörde FDA gemeldet und zusammen mit der Behörde den Infobrief an die Ärzte verfasst. Ob dieser Hinweis überhaupt in Europa aufgenommen wird und somit Serono betrifft, ist nicht sicher und liegt allein in der Verantwortung der Europäischen Zulassungsbehörde in London. Serono steht natürlich in engem Kontakt mit der EMEA, um mögliche Fragen zu beantworten. Sicherheit jedoch bestätigt Im British Journal of Dermatology 156/2007 wurde über weitere Studien berichtet, die sich um die Sicherheit des Wirkstoffs drehten. In fünf europäischen Studienzentren war untersucht worden, wie wirksam und wie sicher der Wirkstoff Efalizumab bei Menschen mit mittelschwerer bis schwerer Schuppenflechte vom Plaque-Typ wirkt. Mit dabei waren 400 Patienten aus Österreich, Dänemark, Griechenland, Italien und Spanien. Sie erhielten bis zu anderthalb Jahre lang das Medikament Raptiva. Das Ergebnis stimmte die Wissenschaftler positiv, was hachhaltige Wirksamkeit und längerfristige Sicherheit betrifft. An der Uni Wien beispielsweise gelang mit Raptiva bei zwei Drittel der Patienten innerhalb von zwölf Wochen ein Zurückdrängen der Psoriasis um die Hälfte. Das blieb auch so, wenn das Medikament weiter gegeben wurde. Der Erfolg hielt bis zu anderthalb Jahre an. In Rom waren die Erfahrungen der Ärzte ähnlich. Für Professor Knud Kragballe von der Uni-Klinik Aarhus war die gute Verträglichkeit wichtig, die eine langfristige Kontrolle der Symptome mit geringen Nebenwirkungen möglich macht und die Patienten bei der Stange hält. 71 Prozent der Patienten sprachen nach zwölf Wochen auf die Behandlung mit Efalizumab an. 77 Prozent derjenigen, bei denen Raptiva angeschlagen hatte, setzten die Therapie danach kontinuierlich fort. Die Wissenschaftler an der Uni-Klinik in Barcelona erklärten, sie mögen an Raptiva, dass die Therapie so einfach ist und leicht in den Alltag integriert werden kann. Daten aus drei Jahren Studien Wenn Raptiva in den ersten 12 Wochen hilft, kann die Wirkung auch länger anhalten. Das beweist eine prospektive Studie, in der das Medikament mit dem Wirkstoff Efalizumab erstmals über drei Jahre hinweg untersucht wurde. In der Studie ging es um die Wirksamkeit und die Sicherheit von Efalizumab in der Behandlung einer mittelschweren bis schweren chronischen Schuppenflechte vom Plaque-Typ. In den ersten 12 Wochen hatten 82 Prozent der Patienten auf Raptiva angesprochen. Nach drei Jahren half das Medikament bei 73 Prozent dieser "Ansprecher" immer noch: Die Psoriasis hatte sich um 75 Prozent gebessert. Raptiva wurde außerdem gut vertragen. Dr. Craig L. Leonardi von der Saint Louis University (US-Bundesstaat Missouri) wiegt die Therapie mit Biologics gegen andere Langzeit-Therapien auf: Eine UV-Therapie kann unbequem sein. Eine Therapie mit Ciclosporin oder MTX kann eine erhöhte Toxizität mit sich bringen. Für ihn ist Efalizumab für eine Langzeit-Behandlung der Psoriasis vom Plaque-Typ geeignet. An der Studie hatten 339 Patienten mit einer mittelschweren bis schweren Schuppenflechte teilgenommen. In den ersten drei Monaten erhielten sie einmal in der Woche zwei Milligramm pro Kilogramm Körpergewicht unter die Haut gespritzt. Diejenigen, bei denen sich die Psoriasis um 50 Prozent und mehr gebessert hatte, konnten weitermachen - sie qualifizierten sich damit sozusagen für die Langzeitbehandlung. Also erhielten sie die nächsten 33 Monate lang jede Woche ein Milligramm pro Kilogramm Körpergewicht. Wer im vierten bis 15. Monat einen Rückfall seiner Psoriasis erlebte, bekam ab dem nächsten Quartal eine erhöhte Dosis von zwei bis vier Milligramm pro Kilogramm Köpergewicht. Von den 290 Patienten, die nach den ersten drei Monaten in die Langzeit-Phase kamen, schlossen noch 146 die gesamte Studie ab. Es wurden also nur Patienten berücksichtigt, die die Therapie fortsetzen, nicht aber jene, die die Behandlung wegen einer Nebenwirkung, wegen fehlender Wirksamkeit oder aus anderen Gründen abbrechen. Nebenwirkungen im Langzeittest Raptiva wurde laut Forschern "im Allgemeinen gut vertragen und zeigte keine Anzeichen von kumulativer oder Endorgantoxizität". Mehr als fünf Prozent der Patienten klagten über Nebenwirkungen wie verstärkter Husten Rhinitis Sinusitis und unspezifische Infektionen (beispielsweise Erkältungen) Die Forscher sind sich aber auch bewusst, dass bei so wenigen Patienten keine seriöse Aussage über seltene Nebenwirkungen möglich ist. Nur ein kleiner Teil - weniger als 3,1 Prozent - musste die Studie wegen Nebenwirkungen abbrechen. Finale Im März 2008 kamen die ersten Warnhinweise auch aus Europa: Am 10. März 2008 verschickten die Firma Serono und die Arzneimittelkommission der deutschen Ärzteschaft einen Rote-Hand-Brief an alle Ärzte. Darin wurde über ernsthafte Erkrankungen und Todesfälle während der Einnahme von Raptiva berichtet. Im November 2008 informierte die Firma Serono dann über den Fall einer progressiven multifokalen Leukenzephalopathie (PML). Im Februar 2009 empfahl die Europäische Arzneimittelbehörde, dass die Zulassung Raptiva fortan besser ruhen sollte. Einige Tage später wurden alle Ärzte darüber wiederum von der Arzneimittelkommission der deutschen Ärzteschaft in einem weiteren Rote-Hand-Brief informiert. Ärzte in der Europäischen Union sollen keine neuen Rezepte für Raptiva ausstellen. Bei Patienten, die bisher mit Raptiva behandelt wurden, sollte überprüft werden, welche anderen Behandlungsmöglichkeiten denkbar sind. Die Ärzte sollen außerdem dafür sorgen, dass die Patienten sorgfältig auf neurologische Symptome und Anzeichen einer Infektion untersucht werden. Wer derzeit Raptiva nimmt, sollte die Therapie nicht abrupt abbrechen, sondern einen Termin beim Arzt ausmachen. Bis dahin waren inzwischen drei Fälle einer progressiven multifokalen Leukoenzephalopathie (PML) aufgetreten. Zwei der Fälle traten in den USA auf, einer in Deutschland. Die ersten beiden Fälle betrafen Patienten über 70, die mehr als vier Jahre lang mit Raptiva behandelt wurden. Deutlich jünger war ein 47-Jähriger Deutscher, der Raptiva drei Jahre lang gespritzt hat. Ein weiterer Fall ist noch nicht bestätigt. Der Fachausschuss der EMEA hatte noch einmal über Nutzen und Risiko des Medikamentes befunden. Angesichts der schweren Fälle kamen die Experten zu dem Schluss, dass die Risiken von Raptiva größer sind als sein Nutzen. Mehr über Raptiva Raptiva war ein so genannter humanisierter therapeutischer Antikörper. Er blockiert die Aktivierung, Reaktivierung und den Austausch der T-Zellen, die für die Entstehung der Psoriasis verantwortlich sind. Raptiva wurde einmal in der Woche unter die Haut gespritzt. Es konnte – nach anfänglicher Unterweisung beim Arzt – vom Patienten zu Hause angewendet werden. Die Herstellerfirma hatte vor der Zulassung mehr als 3.500 Patienten in den USA und in Europa mit Raptiva untersucht. Mehr als 200 Patienten nutzten bis dahin Raptiva seit über zweieinhalb Jahren ununterbrochen. So war die damals größte Datenbank zum Einsatz eines zugelassenen biologischen Medikaments gegen Psoriasis entstanden. Die häufigsten Nebenwirkungen waren Kopfschmerzen Infektionen (z.B. Erkältungen), Schüttelfrost Übelkeit Kraftlosigkeit und Fieber Alle Nebenwirkungen gingen nach den ersten beiden Injektionen zurück. Nach 30 Monaten Behandlung waren nur selten schwerwiegende Nebenwirkungen übrig - so war es schon in Phase III der Studien zu beobachten. Keine ausreichende Wirkung bei Psoriasis arthritis In Phase II einer Studie mit Psoriasis-arthritis-Patienten zeigten sich keine Vorteile. In den Studien sollte sich die Psoriasis arthritis bei den Patienten um mindestens 20 Prozent bessern. 28 Prozent der Patienten erreichten diesen Wert. Doch auch unter denen, die nur ein Placebo (ein Schein-Medikament) erhielten, zeigte sich bei 19 Prozent auch eine solche Besserung. Tipps zum Weiterlesen Erfahrungen mit Raptiva In unserer Community diskutierten Patienten über das Medikament, seine Anwendung und die Folgen. Raptiva-Patientin verklagt Hersteller wegen Hodgkins-Lymphom (engl.) Bloomberg, 07.01.2011 Efalizumab erklärt bei Wikipedia "Efalizumab (Raptiva): Ruhen der Zulassung empfohlen" arznei-telegramm, 03/2009 Quellen: Nachrichtenagentur Reuters Pressemitteilungen der Firma Genentech Foxnews | Reuters I | Reuters II zur Warnung vor schweren Nebenwirkungen (alle 20. Juli 2005) Pressemitteilung der Firma Merck-Serono zur EMEA-Empfehlung, die Zulassung ruhen zu lassen "Efalizumab: results of a 3-year continuous dosing study for the long-term control of psoriasis", British Journal of Dermatology 2008, Heft158 Angaben des Herstellers- 3 Kommentare
-
- Biologika
- Nebenwirkungen
-
(und 2 mehr)
Markiert mit:
-

Allergie-Medikament macht Fumaderm nicht verträglicher
Claudia Liebram erstellte ein Artikel in Dimethylfumarat
Das Medikament Fumaderm hilft unbestritten vielen Menschen mit Schuppenflechte. Doch die Nebenwirkungen des Haupt-Wirkstoffs Dimethylfumarat sind gefürchtet: Da wird die Haut plötzlich heiß und rot – oder der Darm meldet sich vehement zu Wort. Milch oder Joghurt, zum richtigen Zeitpunkt "eingenommen", sind einige der Strategien, die Patienten entwickelt haben, um das Medikament für sich erträglicher zu machen. Weitere Tipps sind sicherlich bei jedem, der sich mit den Nebenwirkungen herumplagt, willkommen. Klar ist nun: Cetirizin hilft da nicht. Der Wirkstoff wird für gewöhnlich gegen Allergien eingesetzt. Niederländische Forscher um Deepak Balak teilten für eine Studie 50 Anwender von Dimethylfumarat in zwei Gruppen ein. Die eine nahm zuätzlich zum Medikament 10 Milligramm Cetirizin ein. Die andere bekam ein Placebo. Nach drei Monaten stand fest: Die Zahl der Nebenwirkungen unterschied sich bei beiden Gruppen nicht deutlich. Die holändischen Wissenschaftler gehen davon aus, dass 30 bis 40 Prozent der Anwender von Dimethylfumarat die Behandlung wegen der Nebenwirkungen abbrechen. Die Ergebnisse der Studie erschienen im "British Journal of Dermatology". "Geheimtipps", wie die Nebenwirkungen gelindert werden können, findest du immer wieder in unserem Forum. -

Fumarsäure-Ester-Präparate können Nieren schädigen
Rolf Blaga erstellte ein Artikel in Dimethylfumarat
Die Arzneimittelkommission der Deutschen Ärzteschaft (AKdÄ) hat im Juni 2014 darauf hingewiesen1, dass als Nebenwirkung von Fumaderm und Tecfidera Einzelfälle akuten Nierenversagens aufgetreten sind. Patienten sollten sich unbedingt an die empfohlenen Untersuchungstermine für die Laborwerte halten. Wer – neben den typischen Magen-Darm-Problemen – zusätzlich Fieber bekommt, sollte damit sofort zum Arzt gehen. Der wird dann die Retentionswerte bestimmen lassen. Damit kann er einschätzen, ob es Nierenprobleme gibt. Ein akutes Nierenversagen („akute Niereninsuffizienz“) ist ein schwerwiegendes Ereignis. Patienten, die mit einem Fumarsäure-Präparat behandelt werden, müssen trotzdem nicht in Panik geraten. In den beschriebenen Einzelfällen (!!!) hat sich die Nierenfunktion wieder normalisiert, nachdem das Präparat abgesetzt wurde. In der Datenbank für Unerwünschte Arzneimittelwirkungen, so das AKdÄ, würde Fumaderm in 18 Fällen mit Veränderungen der Nierenfunktion in Verbindung gebracht, darunter auch solche mit akutem Nierenversagen. Das sind angesichts der mehr als 200.000 Patientenjahre2 extrem selten vorkommende Nebenwirkungen. In der Fachinformation von Fumaderm heißt es zu Nierenversagen, die Häufigkeit sei „unbekannt“. Erhöhte Serum-Kreatinin-Werte, die darauf hinweisen, dass die Niere geschädigt sein könnte, treten danach bei Fumaderm nur "gelegentlich" auf – das heißt, bei 0,1 Prozent bis 1 Prozent der behandelten Patienten. Tecfidera (Wirkstoff: Dimethylfumarat) ist nur für die Behandlung der Multiplen Sklerose (MS) zugelassen. In absehbarer Zeit wird dieser Wirkstoff von anderen Herstellern auch für Psoriasis-Patienten angeboten werden. Bei diesem Wirkstoff gelten Eiweiße im Urin (Protein, Albumin) als „häufig“ (1 Prozent bis 10 Prozent der behandelten Patienten). Keton-Körper treten sogar "sehr häufig" (10 Prozent und mehr) auf. Beides können Anzeichen für Leber-Schädigungen sein. Die europäische Zulassungsbehörde EMA bewertet den Wirkstoff Dimethylfumarat grundsätzlich nicht als nierenschädigend. Einzelne Schädigungen der Nieren- oder Leber-Kanälchen (Tubuli) gelten jedoch als mögliches Risiko. Patienten, die Fumarsäure-Präparate nehmen, sollten Blutbild, Leberwerte und Nierenfunktion regelmäßig überprüfen lassen3. Langfristig geplante Untersuchungstermine vergisst man eher nicht, wenn sie im Kalender oder Terminplaner eingetragen sind. Die Leitlinie S 3 zur Therapie der Psoriasis vulgaris empfiehlt folgende Laborkontrollen: Blutbild (Erythrozyten, Leukozyten, Thrombozyten sowie Differenzialblutbild) Überprüfung der Leberwerte (Transaminasen, Gamma-GT) Serumkreatinin Urinstatus Wie oft sollen die Laborkontrollen passieren? Dazu empfiehlt die Leitlinie: vor der ersten Einnahme bis zum 4. Monat alle 4 Wochen danach alle 8 Wochen Deutsches Ärzteblatt, Jg. 111, Heft 25, 20.06.2014 Zahl des Herstellers Biogen-Idec: 200.000 Patientenjahre bedeutet z.B. vereinfacht, dass 20.000 Patienten zehn Jahre lang Fumaderm genommen haben. Der Hersteller empfiehlt für Fumaderm in der Fachinformation Laboruntersuchungen u. a. von Serum-Kreatinin sowie Protein im Urin und Harnsediment während der ersten vier Wochen alle zwei Wochen, danach alle vier Wochen. Bei Anstieg des Kreatinins über die Norm soll die Behandlung mit Fumaderm abgebrochen werden. Neben der Überwachung der Nierenfunktion werden regelmäßige Kontrollen von Blutbild und Leberwerten empfohlen.-
- Fumaderm
- Nebenwirkungen
-
(und 3 mehr)
Markiert mit:
-

Rote-Hand-Brief wegen Nebenwirkungen von Fumaderm
Claudia Liebram erstellte ein Artikel in Dimethylfumarat
Im Sommer 2013 bekam es jeder Arzt landauf landab schriftlich: Beim Wirkstoff Dimethylfumarat (enthalten z.B. in Fumaderm) ist Vorsicht geboten – und zwar, wenn die Zahl der Lymphozyten extrem abnimmt. Die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) verschickte damals einen Rote-Hand-Brief an alle Ärzte. Der heißt so, weil darauf eine rote Hand abgebildet ist, die den Arzt auf ernstere Probleme aufmerksam machen soll. Absender des Briefes ist die Firma Biogen-Idec, Hersteller von Fumaderm. Im Frühjahr 2013 war mehrfach über einige Fälle schwerer Nebenwirkungen berichtet worden. "Der Hersteller weist auf das Risiko opportunistischer Infektionen bei schwerer, anhaltender Lymphopenie hin", heißt es von der AkdÄ. Das bedeutet: Wenn die Lymphozyten-Zahl dauerhaft viel zu niedrig (unter 500/µl) ist, drohen Infektionen, verursacht durch Keime. Die Fachinformation für Ärzte – eine Art ausführlicher Beipackzettel – sollte danach aktualisiert werden. Darin sollte dann konkret beschrieben werden, was im Falle einer Lymphopenie unternommen werden kann. Wichtig ist, was in der Fachinformation zu lesen ist: Vor der Behandlung ist das Blutbild (einschließlich Differentialblutbild sowie Blutplättchenzahl) zu kontrollieren: Bei Werten außerhalb des Normbereiches darf keine Behandlung erfolgen. Während der Behandlung sind regelmäßige Blutbildkontrollen durchzuführen (Leukozytenzahl und Differentialblutbild; in den ersten drei Monaten alle 14 Tage, danach bei unauffälligen Befunden monatlich). Bei starker Abnahme der Leukozytenzahl – insbesondere bei Werten unter 3000/μl – oder anderen pathologischen Blutbildveränderungen ist die Behandlung sofort abzubrechen. Blutbildkontrollen sind dann bis zur Normalisierung nötig. Die AkdÄ fordert zudem alle Ärzte auf, ihr alle Nebenwirkungen im Zusammenhang mit dem Wirkstoff mitzuteilen – auch, wenn es sich zunächst nur um einen Verdacht handelt. Diese Meldung kann auch online erfolgen. Das Fazit für alle Betroffenen, die Fumaderm einnehmen: Die regelmäßigen Laborkontrollen sollten ernst genommen werden - wie oben beschrieben anfangs alle 14 Tage, nach drei Monaten und wenn alles in Ordnung ist, nur noch einmal im Monat.- 2 Kommentare
-
Blutdrucksenkende Medikamente, insbesondere Betablocker, stehen im Verdacht, eine Psoriasis auslösen zu können. Auch wird ihnen nachgesagt, sich möglicherweise negativ auf eine bereits bestehende Psoriasis auszuwirken. Inzwischen bringt eine Metaanalyse solch lang gehegten Annahmen stark ins Wanken. Die Forscher trugen Ergebnisse von Studien aus dem Zeitraum zwischen 1994 und 2005 zusammen. Dabei wurden Krankheitsverläufe und Begleitmedikationen von 36.702 Patienten analysiert, die erstmalig an Schuppenflechte erkrankt waren, und mit der gleichen Anzahl an Menschen gleichen Alters und Geschlechtes – aber ohne Hauterscheinungen - verglichen. Die große Überraschung: Die Wissenschaftler entdeckten keinen Zusammenhang zwischen dem Auftreten einer Psoriasis und der Einnahme von Betablockern. Auch die Einnahme von anderen blutdrucksenkenden Medikamenten hatte keinerlei Einfluss auf die Entstehung der Hautkrankheit. Das heißt: Die Patienten, die Betablocker einnahmen, entwickelten genauso häufig eine Psoriasis wie die Menschen der Kontrollgruppe. Ob die Blutdrucksenker eine bereits bestehende Psoriasis verschlechtern würden, konnte aus den Daten jedoch nicht entnommen werden. Etwa jeder dritte Patient beziehungsweise jede dritte Patientin zwischen 40 und 64 Jahren erkrankt in Deutschland an Bluthochdruck, ab dem 65. Lebensjahr ist es sogar die Hälfte aller Patienten. Medikamente der ersten Wahl sind nach wie vor Betablocker, die den Blutdruck senken und somit die Gefahr mindern sollen, einen Herzinfarkt oder Schlaganfall zu erleiden. Doch kein Medikament ohne Risiken und Nebenwirkungen. Bei Betablockern beziehen sich die Warnhinweise unter anderem auf Psoriasis. So sollte der gängige Betablocker Concor (Bisoprolol) beispielsweise bei „akuter oder früherer Psoriasis bzw. Psoriasis in der Familie“ nur „wenn unbedingt notwendig, eingenommen werden“. Allerdings weiß scheinbar niemand genau, weshalb Betablocker die Haut negativ beeinflussen könnten. Diskutiert werden Auswirkungen auf den Zellstoffwechsel der T-Zellen des Immunsystems, die an den entzündlichen Prozessen beteiligt sind. Andere vermuten einen Einfluss der Medikamente auf die Nebennierenrinde, wo normalerweise Glukokortikoidhormone gegen Entzündungsprozesse im Körper gebildet werden. Eine dritte Hypothese beruht auf einer Hemmung eines Botenstoffes namens zyklisches Adenosinmonophosphat (cAMP), der im Körper zahlreiche Prozesse steuert. Wissenschaftliche Beweise gibt es bisher jedoch zu keiner dieser Theorien. Derartige Warnhinweise beruhen mehr oder weniger auf Fallberichten, schreibt Professor Sebastian Harder vom Institut für klinische Pharmakologie der Universität Frankfurt in einer Stellungnahme, abgedruckt in der "Medical Tribune" vom Oktober 2004. Im Bezug auf die Anzahl der mit Betablockern behandelten Patienten trete ein Zusammenhang zwischen Betablocker Gabe und dem Auftreten beziehungsweise der Verschlechterung psoriatischer Hauterscheinungen nur selten auf. Dennoch hielt er noch vor acht Jahren die Zusammenhangswahrscheinlichkeit als ausreichend gesichert. „Nach der Meta-Analyse kann die Sache wohl etwas entspannter gesehen werden“, erklärt er heutzutage, obwohl es dennoch immer wieder aktuelle Fallberichte und Warnmeldungen gibt. „Ich denke, ein präventives Absetzen ist nicht angemessen, auch ist die Psoriasis keine Anwendungsbeschränkung für Betablocker“, so Harder. Wenn Betalocker ausschließlich zur Blutdrucksenkung verordnet würden und andere therapeutische Maßnahmen zur Verfügung stünden, könne man versuchen, einen beginnenden Schub durch Ausschleichen der Medikamente einzudämmen. Unverzichtbar sind Betablocker jedoch nach einem Infarkt, bei Vorhofflimmern oder Gefäßerweiterungen am Herzen. In diesen Fällen empfiehlt Harder, zunächst einen Wirkstoffwechsel auszuprobieren. Ähnlich sieht es Professor Kristian Reich, Gründungsmitglied des SCIderm (Scientific Research, Clinical Studies and Innovative Consulting) in Hamburg. „Bei den meisten Patienten sehe ich kein Problem“, sagt er. Sicher gäbe es manche Patienten, bei denen sich die Psoriasis unter Betablockern verschlechtert oder eine Psoriasis ausbricht. Ob dies aber tatsächlich an den Betablockern liege, sei nicht nachvollziehbar. Die Ergebnisse der Meta-Analyse aus dem Jahr 2008 bestätigen Reichs Ansicht. Allerdings haben sich diese neuen Erkenntnisse in der Praxis bis heute nicht ausgewirkt, sagt Reich. Seiner Meinung nach ist es das Wichtigste, die Psoriasis optimal zu behandeln – ob mit oder ohne Betablocker.
- 14 Kommentare
-
- Betablocker
- Bisoprolol
-
(und 3 mehr)
Markiert mit:
-
In der menschlichen Haut tickt eine innere Uhr. Die ist unter anderem dafür zuständig, wann im Laufe eines Tages dort repariert und regeneriert wird. Forscher der Berliner Uni-Klinik Charité und vom Hamburger Hautforschungszentrum haben Grundlagenforschung zu diesem Thema betrieben und erste Ergebnisse in der Fachzeitschrift „Proceedings of the Academy of Science“ veröffentlicht. Die Haut ist ein lebenswichtiges und vielseitiges Organ: Neben repräsentativen, kommunikativen und sensorischen Funktionen übernimmt sie die Abgrenzung des Körpers zur Umwelt. Sie bildet eine Barriere gegen Keime und hilft, die Bedingungen für andere wichtige Systeme des Körpers konstant zu halten. Das tut sie, obwohl auf sie sehr unterschiedliche Umweltbedingungen wie Frost, Hitze, Sonnenlicht und Nässe einstürmen – und das je nach Tageszeit ganz unterschiedlich. Die Forscherteams um Professor Achim Kramer vom Arbeitsbereich Chronobiologie an der Charité und Dr. Thomas Blatt vom Hamburger Hautforschungszentrum fanden heraus, wie sich die Haut diesen tageszeitabhängigen Bedingungen anpasst. Zellteilung gebremst Sie entnahmen jungen gesunden Probanden zu verschiedenen Zeitpunkten des Tages Hautzellen der obersten Hautschicht - sogenannte Keratinozyten. Eine Analyse sämtlicher Gene in den Keratinozyten ergab, dass wichtige Faktoren für die Regeneration und Reparatur der Hautzellen von der biologischen Uhr reguliert werden. Einer dieser Faktoren - das Krüppel-like-factor 9 („Klf9“) genannte Molekül - bremst die Zellteilung in den Keratinozyten. Drehten die Forscher den Regler für die Aktivität dieses Faktors herunter, wuchsen die Hautzellen in der Zellkulturschale schneller. Ein Ankurbeln der Aktivität von „Klf9“ sorgte für eine langsamere Zellteilung – und das ist der Punkt, an dem die Psoriasis ins Spiel kommt. Die ist geprägt davon, dass sich die Hautzellen zu schnell teilen. Beste Tageszeit für minimale Nebenwirkungen Bei den Untersuchungen zeigte sich, dass auch das Stresshormon Cortisol die Aktivität von „Klf9“ steuert und darüber seine medizinische Wirkung bei häufigen Hauterkrankungen wie der Schuppenflechte entfalten könnte. Die biologischen Uhr steuert das exakte Timing der verschiedenen Prozesse wie Zellteilung, Zelldifferenzierung und DNA-Reparatur in der Haut. Professor Kramers Prognose: „Wenn wir diese Prozesse noch besser verstehen, könnten wir Medikamente gezielt zu den Tageszeiten einsetzen, an denen sie am besten wirken und die wenigsten Nebenwirkungen haben.“ c Quelle: Florian Spörl, Thomas Blatt, Achim Kramer et al.: "Krüppel-like factor 9 is a circadian transcription factor in human epidermis that controls proliferation of keratinocytes". In: Proceedings of the Academy of Science (PNAS) 109 (03.07.2012)
-
- Chronobiologie
- Cortisol
-
(und 3 mehr)
Markiert mit:
-
Wer über Jahre eine chronische Erkrankung wie die Schuppenflechte mit sich herumschleppt, wird vermutlich irgendwann von Bekannten oder Verwandten auf dieses und jenes Wundermittel hingewiesen. Darunter dürfte ziemlich oft MMS sein. Vom „Miracle Mineral Supplement“ werden diverse Geschichten erzählt. Fast alle klingen wie Märchen. Das Bundesamt für Risikobewertung (BfR) holt die Verfechter in die Realität zurück: Es rät von der Einnahme ausdrücklich und dringend ab. Demnach wird MMS als Lösung in kleinen Flaschen angeboten. Oft wird ein weiteres Fläschchen dazu verkauft. Das enthält eine verdünnte Säure, die den Inhalt der ersten Flasche „aktivieren“ soll. Gemeldete Nebenwirkungen von MMS Dem BfR liegen Meldungen aus dem Ausland vor. Darin berichten MMS-Anwender von Bauchschmerzen Übelkeit Erbrechen Durchfall Blutdruckstörungen erheblichem Flüssigkeitsverlust Äußerlich in falscher Dosierung aufgetragen, kann MMS die Haut und Schleimhaut laut BfR reizen oder gar verätzen. Dabei muss nicht einmal der Anwender die Mischung falsch ansetzen – manchmal kann eine als gebrauchsfertig deklarierte Lösung ab „Werk“ falsch gemischt sein. In MMS steckt Natriumchlorit. Das starke Oxidationsmittel sollte nicht mit Natriumchlorid – landläufig Kochsalz genannt – verwechselt werden. Aus erst genanntem Natriumchlorit und der hinzugemixten Säure entsteht Chlordioxid – eine Säure, die stark reagiert. Das BfR schreibt, dass es sich bei MMS „nicht um eine sinnvolle Ergänzung der Ernährung mit Mineralstoffen handelt“. Gesundheitsbehörden anderer europäischer Länder sowie in Kanada und den USA raten ebenfalls von der Anwendung von MMS ab. Am 30. Mai 2014 veröffentlichte das Bundesinstitut für Arzneimittel und Medizinprodukte eine Warnung vor der Anwendung von Miracle Mineral Supplement (MMS). Gesundheitsämter der Bundesländer zogen nach – beispielsweise das von Mecklenburg-Vorpommern. Im maiLab war das Miracle Mineral Supplement auch Thema. Tipps zum Weiterlesen Was Behörden und Facebook (nicht) tun Mehr zum Thema MMS haben die Kollegen von Medwatch aufgeschrieben. Übersicht ansehen "Miracle Mineral Supplement (MMS): Erhebliche Gesundheitsgefahr" Zusammenfassung vom Verbraucherzentrale Bundesverband [lesen] MMS und Jim Humble – die Fakten Artikel lesen Werbung für MMS auseinandergenommen (Blog "Unser täglich Spam", 30.03.2014) Im Blog "Unser täglich Spam" geht es um – wen wundert es: Spam. Die blumigen, viel versprechenden Mails werden sozusagen seziert. Jetzt ist dem Autoren eine Spam-Mail zum Mineral MMS untergekommen – dem Mittel, das auch bei uns immer wieder mal durchs Forum geistert. Artikel lesen MMS ist giftige Chlorbleiche – na und? (Spiegel online, 04.03.2014) "Spiegel online" berichtet über das Mittel MMS und seine Anhänger. Letztere schlagen Warnungen in den Wind. Auf einer Esoterik-Messe huldigen sie lieber dem Erfinder Jim Humble. Artikel lesen
-
- Nahrungsergänzungsmittel
- Nebenwirkungen
-
(und 1 mehr)
Markiert mit:
-
Es gibt Medikamente, die zu Beschwerden oder ernsthaften Problemen mit den Augen führen können. Diese unerwünschte Arzneimittelwirkungen reichen von trockenen oder geröteten Augen bis hin - im Extremfall- zum Verlust des Augenlichts. Darauf verweist Dr. Bettina Wick-Urban in der Pharmazeutischen Zeitung vom 14.06.2012. Unter den von ihr aufgeführten Medikamenten gibt es einige, die typischerweise Patienten mit Schuppenflechte oder Psoriasis arthritis verwenden. Wer also Beschwerden oder Probleme mit den Augen hat, sollte nicht nur umgehend zum Augenarzt gehen, sondern auch die Arzneimittel mitnehmen, die er zur Zeit benutzt. Die Autorin hebt hervor, dass Nebenwirkungen im oder am Auge nicht nur von innerlichen, sondern auch von äußerlichen Wirkstoffen herrühren können. Das gelte zum Beispiel für Corticoide (Kortison), innerlich angewendet. Bei 25 Prozent der Anwender würde sich nach zwei Wochen der Augendruck erhöhen, so Wick-Urban. Bei einem Drittel von ihnen (8,5 Prozent) würde sich der Augendruck sogar gefährlich entwickeln. Bei ihnen könne der Sehnerv geschädigt werden, bis hin zum Verlust des Augenlichts. Eine Linseneintrübung (Katarakt) riskiere, wer über längere Zeit hohe Dosen Kortison einnimmt. Diese Schädigung gehe selten zurück, wenn das Medikament abgesetzt wird. Langfristig drohe, so Wick-Urban, der Verlust des Sehvermögens. Deshalb sollten Patienten, die über längere Zeit mit Kortison behandelt werden würden, alle drei bis sechs Monate zur Augenkontrolle gehen. Professor Matthias Augustin hatte 2010 darauf hingewiesen, dass bei Psoriasis am häufigsten Kortisonpräparate zum Einnehmen verschrieben werden – entgegen der offiziellen Therapieempfehlung für Hautärzte. Auch Wollwachs (Lanolin), das als Salbengrundlage dient, könne zu allergischen Reaktionen führen, so die Autorin. Sehr hilfreich in dem Artikel ist eine Tabelle, in der sie auflistet, welche Augenerkrankungen durch welche Wirkstoffe auftreten können. Für Psoriatiker interessant sind COX2-Hemmer (entzündungshemmende bei Psoriasis arthritis) Antihistaminika (gegen Juckreiz) Vitamin A (Neotigason) Ciclosporin und Glucokortikoide (Kortison) Auf der Liste der Medikamente, die „ins Auge gehen können“, stehen außerdem Anti-Baby-Pillen, Beta-Blocker, das Malariamittel Chloroquin und Blutgerinnungshemmer. Dr. Bettina Wick-Urban rät eindringlich, „verdächtige“ Medikamente beim ersten Anzeichen sofort abzusetzen. In einigen Fällen würde man sonst dauerhafte Schädigungen riskieren.
- 3 Kommentare
-
- Antihistaminika
- Augen
-
(und 3 mehr)
Markiert mit:
-
Im Laufe der Jahre wurde der Wirkstoff Adalimumab, der in Humira enthalten ist, mehreren Studien unterzogen – sowohl vor der Zulassung als auch danach. Wir schreiben hier eher protokollarisch wichtige Ergebnisse einiger Studien auf. Adept (zusammengesetzt aus: Adalimumab Effectiveness in Psoriastic Arthritis Trial) ADEPT war eine placebokontrollierte, doppelblinde Studie. Darin wurden die Wirksamkeit und Verträglichkeit von Humira bei 313 Erwachsenen mit mäßiger bis schwerer, aktiver Psoriasis arthritis untersucht. Bei ihnen hatten Entzündungshemmer ohne Kortison (nichtsteroidale Antiphlogistika) nicht geholfen. “Mitbringen” mussten sie drei oder mehr geschwollene Gelenke und drei oder mehr schmerzende Gelenke. Den Patienten wurde jede zweite Woche subkutan (unter die Haut) ein Scheinmedikament (Placebo) oder 40 mg Humira gespritzt. Nach 12 Wochen waren die Gelenkschmerzen und arthritischen Probleme bei 60 Prozent der Patienten um 20 Prozent besser. Nach 24 Wochen hatte fast ein Viertel der Patienten 70 Prozent weniger Schmerzen und Probleme. Ein weiterer gemessener Wert heißt mTSS. Damit wird die Knochenerosion (Abtragung) und die Verengung des Gelenkspalts beurteilt. Die Patienten mit Humira hatten nach 24 Wochen deutlich weniger Veränderungen in diesem Bereich. als die Patienten mit dem Scheinmedikament. 69 der Patienten in der Studie hatten eine Psoriasis, die mehr als drei Prozent der Körperoberfläche befallen hatte. 42 Prozent von ihnen wiesen nach 24 Wochen eine Verbesserung der Psoriasis-Erscheinungen um 90 Prozent (!) auf. Ein Drittel dieser Patienten hatte das gute Ergebnis schon nach 12 Wochen erreicht. Es bliebt bei ihnen bis zum Ende der Studie so. Kein einziger Patient mit dem Scheinmedikament erreichte diese sehr gute Verbesserung seiner Psoriasis nach 24 Wochen – was nun aber auch nicht weiter wundert. Nebenwirkungen Mehr als fünf Prozent der Patienten mit Humira bekamen unerwünschte oder schwere Nebenwirkungen zu spüren, zum Beispiel Infektionen der oberen Atemwege Nasopharyngitis (Entzündung des Nasenrachens; meist eine Entzündung der Rachenmandel) Reaktionen an der Einstichstelle Kopfschmerzen Hypertonie (Bluthochdruck) Generell wird Humira in Verbindung gebracht mit Nebenwirkungen wie Schwindelgefühl Infektionen der Harnwege Übelkeit Durchfall Halsschmerzen Herpes simplex Bauchschmerzen Ausschlag und Juckreiz Schmerzen an der Einstichstelle wurde von mehr als jedem zehnten Patienten berichtet. Believe Thema: Wirksamkeit von Adalimumab (1) beteiligte Patienten: 730 Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis, bei denen zuvor mindestens zwei innerliche Therapien fehlgeschlagen oder aus anderen Gründen nicht durchführbar waren Durchführung: 16 Wochen lang Adalimumab entweder zusammen mit Vitamin-D3-/Kortison-Salbe oder mit einer Placebo-Creme Ergebnis: Verbesserung der Psoriasis-Symptome (PASI) um mindestens 75 Prozent bei 70 Prozent der Patienten Verbesserung der Psoriasis-Symptome (PASI) um mindestens 90 Prozent bei 50 Prozent der Patienten Außerdem festgestellt: Kombination mit Salben ohne anhaltenden zusätzlichen Effekt Champion Die Champion-Studie war eine wichtig für die Zulassung von Humira zur Behandlung der Plaque-Psoriasis. An der Champion-Studie waren 271 Patienten in acht europäischen Ländern und in Kanada beteiligt, die 16 Wochen lang mit Humira behandelt wurden. In dieser Studie wurde (erstmals) die Wirkung von Humira mit der des Standard-Medikaments MTX und einem Placebo verglichen. 17 Prozent von ihnen hatten hinterher keine Psoriasis-Anzeichen mehr, also eine Besserung um 100 Prozent. In der Gruppe, die MTX bekam, waren es 7 Prozent. Unter den Patienten, die ein Placebo bekamen, waren immer noch zwei Prozent. Eine Besserung um immer noch 75 Prozent erreichten 80 Prozent der Patienten. Mit MTX waren es 36 Prozent, mit Placebo 19 Prozent - was aber auch beachtlich ist. Reveal Die Reveal-Studie war ebenfalls wichtig für die Zulassung von Humira zur Behandlung der Plaque-Psoriasis. Sie erstreckte sich über 52 Wochen. Darin ging es um die Effizienz des Medikaments, aber auch um die Wirksamkeit. Hier gab es aber keinen Vergleich mit einem anderen Medikament. In den USA und Kanada nahmen 1.200 Patienten mit einer mittelschweren bis schweren Psoriasis an der Studie teil. Nach 16 Wochen erreichten 71 Prozent der Patienten mit Humira eine Besserung ihrer Schuppenflechte um 75 Prozent. 6,5 Prozent der Placebo-Bekommer kamen ebenfalls so weit. 20 Prozent der Humira-Patienten hatten nach der Behandlung keine Stellen mehr. Ein Prozent der Patienten, die "nur" ein Placebo bekamen, erlebten den gleichen Effekt. Ergebnis einer offenen Verlängerung der Studie: 86 Prozent der Patienten, deren PASI in der eigentlichen Studie um mindestens 75 Prozent besser geworden waren, hatten auch nach zwei Jahren noch ein genauso gutes oder sogar besseres Ergebnis. Daten aus einer Studie in Phase II Daten aus einer Studie in Phase II belegen eine Verbesserung der Krankheitsaktivität und Lebensqualität (2) Der Wirkstoff Adalimumab wirkt sehr gut und lange: Das Ergebnis einer Studie wurde Hautärzten in den USA während ihrer 63. Jahreskonferenz im Jahr 2005 vorgestellt. Die Studie in Phase II zeigte: Das Biologikum Adalimumab (Medikamentenname: Humira) zeigt im Einsatz bei der Schuppenflechte eine hohe Wirksamkeit und verbessert nachhaltig die Lebensqualität der Patienten. Genauer: Bei fast 70 Prozent der Patienten, die mit 40 Milligramm Adalimumab alle 14 Tage behandelt wurden, verbesserte sich die Krankheitsaktivität um mindestens 75 Prozent. Diese Verbesserung hielt über den 60-wöchigen Behandlungszeitraum - also deutlich länger als ein Jahr - an. Adalimumab (Humira) wird subkutan (unter die Haut) gespritzt. Mehr als ein Drittel der mit Adalimumab behandelten Patienten erreichten eine Verbesserung der Krankheitsaktivität um 90 Prozent. Das ist mehr als üblicherweise in klinischen Studien erwartet wird. Außerdem beurteilten Ärzte das Hautbild ihrer Probanden. Bei fast zwei Dritteln bescheinigten sie ein "klares" oder "nahezu klares" Hautbild. Auch die Lebensqualität der Patienten verbesserte sich im Rahmen der Studie, und das anhaltend: 34,3 Prozent schilderten auch nach einem Behandlungszeitraum von 60 Wochen, dass ihre Lebensqualität "überhaupt nicht" von der Erkrankung beeinträchtigt sei. Diese Ergebnisse belegen, dass eine Therapie mit 40 mg Adalimumab s.c. alle 14 Tage eine nachhaltige Verbesserung der klinischen Zeichen und Symptome der Psoriasis erreicht. Die Art und Häufigkeit der im Rahmen der Studie beobachteten unerwünschten Ereignisse waren mit den Sicherheitsdaten aus den vorausgegangenen Adalimumab-Studien bei rheumatoider Arthritis und Psoriasis Arthritis vergleichbar. Meta-Analysen Thema: Sicherheit von Adalimumab (1) beteiligte Patienten: 1800 Ergebnisse: Sterberate auch nach Langzeit-Therapie nicht erhöht Krebsrisiko nach Langzeit-Therapie niedriger als in der Gruppe gesunder Probanden Quellen: (1) Dr. Diamant Thaci, Uni-Klinik Frankfurt/Main, beim EADV-Kongress in Berlin, zitiert in "Mit TNF-alpha-Blocker gegen schwere Psoriasis", Ärzte Zeitung, 23.10.2009 (2) Quelle: Pressemitteilung der Firma Abbott, 14. März 2005 - 63. Jahreskonferenz des amerikanischen Dermatologen-Verbandes (American Academy of Dermatology - ADD)
-

Bei einigen Biologics auf Gürtelrose achten
Claudia Liebram erstellte ein Artikel in Tabletten und Spritzen
Auf eine bekannte Nebenwirkung von Humira und Remicade haben Forscher mit einer Studie noch einmal hingewiesen: Während der Einnahme der Medikamente ist der Körper offenbar anfälliger für Viren, und so kann es häufiger zu einer Gürtelrose (Herpes zoster) kommen als bei anderen Medikamenten aus der gleichen "Klasse" - den Biologics. Allerdings steht die Gürtelrose als Nebenwirkung auch im Beipackzettel von Enbrel. Nur bei Raptiva und Stelara findet sich kein entsprechender Hinweis. Einzelheiten zur Studie In ihrer Untersuchung schauten die Forscher um Anja Strangfeld vom Deutschen Rheumaforschungszentrum Daten aus der langfristigen Behandlung mit TNF-Blockern und mit "herkömmlichen" Medikamenten (DMARD) an – und zwar bei Patienten mit einer Rheumatoiden Arthritis. Von 5.040 erfassten Patienten gab es 86 Fälle von Herpes zoster. 39 davon geschahen während der Einnahme von TNF-Alpha-Antikörpern. In 23 Fällen war Enbrel im Spiel. "Nur" 24 Fälle kamen während einer Therapie mit herkömmlichen Medikamenten zustande. Die Forscher beobachteten außerdem, dass das Gürtelrosen-Risiko mit Alter und gleichzeitiger innerlicher Kortison-Therapie stieg. Das Fazit der Forscher: Bei der Anwendung der Medikamente Humira und Remicade sollten Patient und Arzt gut auf Anzeichen einer Gürtelrose (Herpes zoster) achten. Quellen: "Rheuma: Gürtelrose durch TNF-Blocker" in: Deutsches Ärzteblatt, 18. Februar 2009 "Risk of Herpes Zoster in Patients With Rheumatoid Arthritis Treated With Anti-TNF-Alpha-Agents" in: Journal of the American Medical Association, 18.02.2009 Bei RA-Therapie auch auf Herpes Zoster achten" in: Ärztliche Praxis, 18.02.2009-
- Biologika
- Gürtelrose
-
(und 5 mehr)
Markiert mit:
-

Wie Patienten mit Biologics-Warnungen umgehen sollten
Rolf Blaga erstellte ein Artikel in Tabletten und Spritzen
In der vergangenen Zeit gab es immer wieder Fälle von schweren Nebenwirkungen, die während oder nach einer Therapie mit einem Biologic auftraten. Anfang Oktober 2008 meldete die Firma Merck Serono, dass ein Raptiva-Patient mit einer seltenen, aber lebensgefährlichen Erkrankung des zentralen Nervensystems infiziert ist. (1) Ein anderer Patient, der ebenfalls mit Raptiva behandelt wurde, sei "aus unbekannter Ursache" verstorben. Nur einen Monat vorher, am 4. September 2008, hatte die US-Gesundheitsbehörde FDA vor einer gefährlichen Pilzinfektion gewarnt. Es gab 45 Todesfälle, die die FDA in Verbindung mit TNF-Alpha-Blockern bringt: Vor allem mit Remicade, weniger mit Enbrel und Humira. (2) Im Juni 2008 hielt die FDA es für möglich, dass bei Kindern und Jugendlichen durch TNF-alpha-Blocker Krebs ausgelöst wird. In 30 Fällen seien Lymphome und andere Krebsarten aufgetreten (2a) Am 17. März 2008 veröffentlichte die FDA eine "Black-Box-Warnung": Enbrel-Patienten hätten ein erhöhtes Risiko, an Infektionskrankheiten bis hin zur Tuberkulose zu erkranken. (3) Schon vorher wies die FDA auf seltene, aber schwere Hautreaktionen nach der Anwendung der TNF-Alpha-Blocker (Enbrel, Humira, Remicade) hin. (4) Am 16. Juli 2008 verschickte Abbott an die Ärzte einen "Rote-Hand-Brief". Es wurde darauf hingewiesen, dass erstmals bei drei Patienten "möglicherweise durch Humira" eine seltene, aber tödliche Krankheit aufgetreten ist. Deren Lymphozyten vermehren sich aggressiv und verdrängen andere Zellen. Seit längerem berichten Patienten, dass sie entweder während der Behandlung oder nach Beendigung eine schlimme Psoriasis oder eine Psoriasis arthritis (PsA) bekommen haben. Wer die Beipackzettel genau studiert, findet viele, oft schwere Nebenwirkungen - sauber auseinandergehalten danach, wie häufig sie bisher aufgetreten sind. Biologics und die Nebenwirkungen Ärzte, die intensive Erfahrungen mit Biologics haben, warnen vor übereilten Reaktionen: Biologics hätten ohne nennenswerte Nebenwirkungen schon sehr vielen verzweifelten Psoriatikern geholfen, bei denen bislang keine andere Therapie angeschlagen hatte. Darüber würde viel zu wenig gesprochen. Die Öffentlichkeit konzentriere sich fast ausschließlich auf diejenigen, bei denen sich die Krankheit hinterher verschlimmert hat oder weitere Krankheiten ausgebrochen sind. Das aber seien sehr wenige im Vergleich zur Gesamtzahl der Biologic-Patienten. Professor Kristian Reich wies im Mai 2008 darauf hin, dass weltweit etwa 100 Fälle dokumentiert seien. Das entspricht bei mehr als zwei Millionen Patienten, die mit einem TNF-Alpha-Blocker behandelt werden, einer Häufigkeit von 0,005 Prozent. (5) Dr. Sandra Philipp verweist im Gespräch mit dem Psoriasis-Netz darauf, dass sich während einer Raptiva-Therapie bei einem Prozent der Patienten die Psoriasis verschlechterte. Wurde Raptiva abgesetzt, gab es bei fünf Prozent einen Rebound – von weltweit 46.000 Anwendern. Extreme Hautreaktionen wie die durch TNF-Alpha-Blocker seien noch seltener und könnten auch bei anderen immunsuppressiven Medikamenten auftreten wie Cyclosporin. Reich betonte ausdrücklich, Hautveränderungen unter der Therapie mit TNF-Alpha-Blockern seien "nicht bedrohlich". Man könne sie in den allermeisten Fällen mit zusätzlichen Therapiemaßnahmen "gut kontrollieren". Biologics und Psoriasis arthritis Bei wie viel Patienten eine Psoriasis arthritis neu auftritt, konnten wir nicht ermitteln. Professor Hans Meffert vermutet gegenüber dem Psoriasis-Netz, dass die Psoriasis arthritis ausbricht, weil sie genetisch bedingt ist, völlig unabhängig davon, ob man mit einem Biologic behandelt wird. Andere Patienten hätten vermutlich bereits Psoriasis arthritis gehabt, ohne es zu merken. Wenn sie vor dem Biologic ihre Hauterscheinungen mit MTX behandelt haben, wären damit auch die Gelenke behandelt worden. Auch Professor Kristian Reich meint, dass bestimmte Patienten "möglicherweise wegen genetischer Faktoren" ein besonderes Risiko tragen. Das könne aber kein Arzt vorher feststellen. Eine "schlummernde" Tuberkulose kann durch alle in der EU zugelassenen TNF-Alpha-Blocker ausgelöst werden. Deshalb muss vor der Behandlung mit Enbrel, Humira oder Remicade ein Tbc-Test gemacht werden - auch hinsichtlich eben jener "schlummernden" Tuberkulose. Während Biologics-Therapie wichtigste Werte kontrollieren Während der Therapie hat der Arzt regelmäßig die entsprechenden Werte zu kontrollieren. Der Patient muss Infekte erkennen und damit so schnell wie möglich zum Arzt zu gehen. Mancher Patient merkt den Infekt aber zu spät, weil das Biologic beispielsweise Fieber unterdrückt. Tbc können alle Patienten bekommen, die mit einem Medikament behandelt werden, das das Immunsystem dämpft. Bei Enbrel zum Beispiel wurde weltweit bei 0,1 Prozent der Patienten Tbc festgestellt - darunter auch aus Ländern mit hoher Infektionsgefahr. Die meisten Nebenwirkungen, so die Ärzte, habe man "gut im Griff". Die "meisten", aber eben nicht alle. Biologika müssen vorsichtig eingesetzt werden, wie alle stark wirksamen Medikamente. Schwere und schwerste Erkrankungen bis hin zu Todesfällen kannte man bisher nur aus den Anfangs-Studien. Generell sind die Patienten durch Biologics immungeschwächt und damit anfälliger für Infekte. Dr. Sandra Philipp weist darauf hin, dass der oben erwähnte Raptiva-Patient auch durch ein anderes immunsuppressives Medikament hätte an PML erkranken können. Statistik und ihre Grenzen "Zahlen über den Zusammenhang von Biologika und starken Nebenwirkungen bzw. Todesfällen sagen nichts darüber aus, welche Krankheiten die Patienten außerdem hatten", so Philipp. "Biologics werden oft Schwerkranken gegeben, die noch weitere Medikamente nehmen. Dadurch ist das Immunsystem im Ganzen ziemlich geschwächt." Im konkreten Fall war der Patient durch eine Operation weniger widerstandsfähig. Auch Pilzinfektionen oder Wüstenfieber mit Todesfällen durch TNF-Alpha-Blocker könnten so erklärt werden. Bisher kommen diese Infekte in Europa selten vor. Unsere Meinung Die Berichte können Patienten Angst machen. Sie stehen völlig im Gegensatz zu den PR-Kampagnen und Hochglanzbroschüren, mit denen gerade diese Firmen in den vergangenen Jahren an die Öffentlichkeit getreten sind. Ist es nach solchen Meldungen für Patienten noch sinnvoll, sich mit einem Biologic behandeln zu lassen? Riskieren Patienten durch Biologics ihre Gesundheit und ihr Leben? Oder werden durch solche Berichte nur verantwortungslos Ängste geschürt? Man erlebt es auf Veranstaltungen und bei vielen Gesprächen: Pharmavertreter und Schulmediziner schätzen die Gefahren nicht so hoch ein, wie sie in den Medien dargestellt werden. Der Nutzen der Biologics sei weitaus größer als die seltenen Einzelfälle. Oft sei nicht wirklich nachgewiesen, dass das Biologic (allein) Schuld sei. Dagegen bezeichnen Vertreter anderer medizinischer Therapie-Ansätze gerade die Biologics als "höchst riskant". Deren wirkliche Risiken würden nur scheibchenweise zugegeben: "Wenn ein Pharmahersteller so etwas publik macht, dürfen wir getrost davon ausgehen, dass das nur die Spitze des Eisbergs ist." US-Behörde warnt erfahrungsgemäß frühzeitig Das ist dann wohl doch etwas zu populistisch: Nach unserer Erfahrung warnt vor allem die US-amerikanische Zulassungsbehörde FDA frühzeitig, ohne etwas zu vertuschen. So war das auch zum Beispiel bei Elidel und Protopic. (6) Den meisten Patienten war vermutlich bisher nicht klar, dass sie mit ähnlich starken Wirkstoffen behandelt werden wie andere Schwerkranke. Die PR-Abteilungen der Pharmafirmen haben den Patienten immer wieder suggeriert, dass mit den Biologics alles ganz einfach sei. Stimmt ja auch – aber nicht für alle! Und wer möchte schon gerne zu denjenigen gehören, bei denen sich die Krankheit noch verschlimmert? Niemanden beruhigt das Argument des "seltenen Einzelfalls", wenn Patienten durch ein Biologic sterben können. So risikobereit ist wohl keiner. Was bleibt den Patienten? Wer gerade mit einem Biologic behandelt wird oder werden soll, muss nicht panisch reagieren. Ob man das Mittel sofort absetzen oder doch zu einer anderen Therapie greifen sollte, muss man mit kühlem Kopf und zusammen mit dem Arzt entscheiden. Niemand sollte sich wegen angeblich "unnötiger Ängste" abwimmeln lassen. Der Arzt soll sachlich darüber informieren, ob ein erhöhtes Infektionsrisiko z.B. durch weitere Medikamente besteht und mit welchen Untersuchungen das überprüft wird. Am Ende muss der Patient entscheiden Aber keiner sollte sich etwas vormachen: Der Arzt kann nicht 100-prozentig erkennen, ob man anfällig für äußerst seltene Krankheiten ist. Und wer in Gegenden reist, in den Blastomykose oder Wüstenfieber vorkommt, hat sicherlich ein erhöhtes Risiko. Letztendlich kann auch der Arzt dem Patienten die Entscheidung nicht abnehmen, ob eine schwere Psoriasis mit einem schweren Wirkstoff (wie es die Biologics sind) behandelt werden sollte. Mehr oder weniger gefährliche Risiken setzen sich Psoriatiker sogar durch UV-Bestrahlung aus: nach neuesten Erkenntnissen steigt auch bei Psoriasis-Patienten dadurch das (manchmal tödliche) Hautkrebs-Risiko. Wir erwarten von den Herstellern der Biologics, dass sie alle bekanntgewordenen Fälle von unabhängigen Experten untersuchen lassen. Wir fordern, dass die Patienten umfangreich darüber aufgeklärt werden, welchen Gefahren sie ausgesetzt sind und womit die Risken verringert werden können. Quellen: (1) PML= progressive multifokale Leukoenzephalopathie (2) "Vor Pilzinfektionen in den USA wird bei einigen Biologics gewarnt", Psoriasis-Netz, September 2008 und FDA-Telefonkonferenz über TNF-Alpha-Blocker vom 04.09.08 (2a) TNF-α-Hemmer: Krebsauslöser bei Kindern und Jugendlichen? (3) "Hersteller muss bei Enbrel die Warnhinweise verschärfen", Psoriasis-Netz, März 2008 (4) Drug Safety Newsletter 2/Winter 2008 der FDA (5) "Einige Biologics bringen Schuppenflechte zum Ausbruch", Psoriasis-Netz, Mai 2008 (6) "Krebs durch Pimecrolimus (Elidel u.a.) und Tacrolimus (Protopic)?", Arznei-Telegramm 05/2003 Tipps zum Weiterlesen "Psoriasis induced by tumor necrosis factor-alpha antagonist therapy: a case series" in: Journal of Rheumatology 02/2007 "First manifestation of Psoriasis vulgaris in tumor necrosis factor recepter-associated periodic syndroms during treatment with etanercept" in: Der Hautarzt, Januar 2008 "Manifestation of palmoplantar pustulosis during of after influximab therapy for plaque-type psoriasis: report on five cases" in: Archives of dermatological research Februar 2008 "Anti-TNF-alpha-Therapie: Immunsuppression fördert Hautkrankheiten" in: hautnah dermatologie 2/2007 "Severe exacerbation of chronic plaque psoriasis following initially effective therapy with efalizumab: clinical characterization and therapeutic management" in: British Journal of Dermatology April 2008 "Why do some biologic agents induce psoriasis or psoriasiform lesions?" in: Nature clinical practice Rheumatology Februar 2008- 1 Kommentar
-
- Biologika
- Nebenwirkungen
-
(und 1 mehr)
Markiert mit:
-

Vor Pilzinfektionen in den USA wird bei einigen Biologics gewarnt
Claudia Liebram erstellte ein Artikel in Tabletten und Spritzen
Biologics helfen ohne Frage vielen Menschen, die mittelschwer bis schwer an der Schuppenflechte, an Psoriasis arthritis oder anderen Autoimmunerkrankungen leiden. Sie bergen aber auch Risiken, und von denen kristallieren sich nach und nach mehrere heraus. Die US-amerikanische Arzneibehörde FDA hat jüngst vor invasiven Pilzinfektionen gewarnt, die während der Behandlung mit TNF-Alpha-Blockern aufgetreten sind. Einige davon gingen sogar tödlich aus. Die Verschärfung der Warnhinweise durch die FDA betrifft vor allem Symptome, die in Europa nicht so oft auftreten - also eher USA-Reisende. Die Hersteller müssen nach diesem FDA-Hinweis vor den Infektionsrisiken warnen. Das tun sie zwar bislang schon auch im Beipackzettel, aber es muss noch deutlicher als bisher geschehen. Speziell genannt werden die TNF-alpha-Blocker mit den Wirkstoffen Infliximab (Handelsname: Remicade), Etanercept (Handelsname: Enbrel) und Adalimumab (Handeslname Humira). In den USA betrifft dies noch ein Medikament mit dem Wirkstoff Certolizumab. Invasive Pilzinfektionen – was ist das? Da wäre zum einen die Histoplasmose zu nennen. Das ist eine nicht ansteckende Infektionskrankheit, die durch einen Pilz übertragen wird. Am häufigsten ist die Lunge betroffen. Die Symptome variieren stark. Genannt werden ein allgemeines Krankheitsgefühl, ein trockener Husten (ohne Auswurf), Brustschmerzen, Fieber, Schüttelfrost, Kopfschmerzen, Muskelschmerzen und Appetitlosigkeit. Die überwiegende Mehrheit der Infizierten hat keine Symptome oder höchstens milde grippeähnliche Symptome. Disseminierte (eine "gestreute", ausgeprägte) Histoplasmose kann sich auf mehrere Organe ausbreiten und tödlich sein, wenn sie nicht behandelt wird. Allerdings muss gesagt werden, dass die meisten Erkrankungen davon in Regionen an den Flüssen Ohio und Mississippi auftraten, in deren Gebiet regelmäßig ganze Histoplasmose-Wellen auftreten. In mindestens 21 Fällen war die Histoplasmose allerdings am Anfang nicht erkannt worden. Andere invasive Pilzinfektionen, die die FDA mit der Behandlung mit TNF-Alpha-Blockern in Verbindung bringt, sind Aspergillose oder Candidiasis. Welche Fakten hat die FDA? Die Behörde hat 240 Berichte von Patienten, bei denen es zu einer Histoplasmose gekommen war. Remicade: 207 Fälle Enbrel: 17 Fälle Humira: 16 Fälle Die FDA hat außerdem Hinweise auf Fälle von "Wüstenfieber" (Kokzidioidomykose) oder Pilzinfektion der Haut und der Lungen (Blastomykose). Wüstenfieber kommt vor allem in den Südstaaten und im Westen der USA, in Mittel- und Südamerika sowie in China, sehr selten aber in Europa vor. Die Blastomykose ist ebenfalls in Amerika deutlich mehr verbreitet als in Europa. 45 der Patienten starben. Alles in allem sollen die Ärzte (in den USA) noch mehr als bisher für die Infektionsrisiken sensibilisiert werden. Die FDA spricht in ihrer Empfehlung für Mediziner sogar davon, dass die TNF-Alpha-Blocker zu den Immunsupressiva zählen - also zu den Medikamenten, die das Immunsystem unterdrücken - wie die "älteren" Medikamente MTX und Ciclosporin auch. Was empfiehlt die FDA den Medizinern? Wenn Patienten kommen und über Fieber, Abgeschlagenheit, Gewichtsverlust, Schwitzen oder Husten klagen, sollten die Ärzte nach einer invasiven Pilzinfektion suchen. Im Verdachtsfall soll der TNF-Alpha-Blocker abgesetzt werden. Bestätigt sich der Verdacht nicht oder wurde die Pilzinfektion behandelt, kann die Behandlung weitergehen. Wichtig zu wissen: Die Verschärfung der Warnhinweise durch die FDA betrifft vor allem Symptome, die in Europa nicht so oft auftreten. Wer in die USA und dort in die beschriebenen Gebiete reist, sollte die Worte der FDA im Hinterkopf haben. Hierzulande sollte ohnehin jeder Arzt wissen, dass während der Behandlung mit Biologics sehr genau auf Infektionen zu achten ist. Ein Biologic-Patient bemerkt Anzeichen für eine Infektion eventuell später. Quellen: Tödliche Pilzinfektionen durch TNF-Blocker (Deutsches Ärzteblatt, 05.09.2008) Pressemitteilung der FDA, 04.09.2008 Information des US-Herstellers Amgen, 04.09.2008-
- Biologika
- Nebenwirkungen
-
(und 2 mehr)
Markiert mit:
-
Erfahrungen austauschen über das Leben mit Schuppenflechte, Psoriasis arthritis und dem ganzen Rest